Les acides aminés sont des composés organiques qui s’assemblent pour former des protéines dans ton corps. Ils jouent un rôle important dans la vie humaine. Environ 20 % du poids du corps humain adulte est constitué d’acides aminés. En effet, pour une personne pesant 70 kg, 14 kg sont des acides aminés. Grâce à cet article, tu sauras absolument tout sur les acides aminés et leurs propriétés !
Sommaire
- Que sont les acides aminés et les acides aminés essentiels ?
- Les besoins en acides aminés essentiels
- Les acides aminés essentiels et leurs fonctions spécifiques
- Recettes savoureuses et riches en acides aminés essentiels
Que sont les acides aminés et les acides aminés essentiels ?
Il existe 20 acides aminés au total, et ils entrent chacun dans l’une de ces deux catégories :
- Essentiels (à ingérer dans l’organisme avec la nourriture)
- Non essentiels (ces types d’acides aminés peuvent être synthétisés par l’organisme)
Les acides aminés essentiels
Comme ton corps ne peut pas fabriquer lui-même les neuf acides aminés essentiels, tu dois les obtenir à partir des aliments que tu manges. Ils comprennent :
- L’histidine
- L’isoleucine
- La leucine
- La lysine
- La méthionine
- La phénylalanine
- La thréonine
- Le tryptophane
- La valine
Lorsque l’on examine attentivement les acides aminés, qui sont les éléments de base de l’organisme, le plus important n’est pas la quantité de protéines que nous consommons par jour, mais la quantité d’acides aminés essentiels que nous introduisons dans le corps (1), (2), (3)

Photo de master1305 sur Freepik.com
Fonctions générales
Matières premières des substances porteuses dans le sang
L’hémoglobine, l’albumine, la transferrine (sont trois protéines qui transportent des substances dans le sang) et les lipoprotéines (HDL, LDL, VLDL, connues sous le nom de cholestérol du sang) sont composées de ces acides aminés.
Création d’enzymes
Les acides aminés sont responsables de toutes les réactions chimiques de notre organisme; amylase, pepsine, lipase (ce sont trois enzymes de digestion) et ALT, AST (enzymes du métabolisme du foie).
Transformation des graisses en énergie
La L-carnitine est une substance chimique fabriquée dans le cerveau, le foie et les reins. Elle aide l’organisme à transformer les graisses en énergie. La L-carnitine est importante pour les fonctions cardiaques et cérébrales, les mouvements musculaires et de nombreux autres processus corporels. La L-Carnitine est un peptide bien connu et largement utilisé comme complément alimentaire. Elle est essentielle au métabolisme des lipides et se compose de deux acides aminés, la lysine et la méthionine.
Apport d’énergie aux muscles
La créatine est une substance que l’on trouve naturellement dans les cellules musculaires. Elle est utilisée pour la fourniture instantanée d’énergie aux muscles dans le corps. Elle se compose de deux acides aminés, la glycine et l’arginine.
Création d’hormones
La quasi-totalité des hormones (l’insuline, le glucagon, l’hormone de croissance, etc.) ont pour origine des acides aminés. Seules les hormones stéroïdiennes telles que la testostérone, les œstrogènes et la cortisone sont synthétisées par des enzymes à partir du cholestérol, et non à partir d’acides aminés. L’hormone thyroïdienne provient d’une acide aminé, la tyrosine (3), (4), (5).
Séquence génétique
Les gènes relient les acides aminés pour former des protéines. Toutes les protéines commencent par le codon AUG, un acide aminé appelé la méthionine. C’est le codon de démarrage de la séquence du génome humaine (4), (6).
Photo de julien Tromeur sur Unsplash.com
Comment expliquer les carences en acides aminés ?
Signes généraux de carence
La carence en protéines se produit rarement de manière isolée. Elle s’accompagne généralement d’une carence en énergie et en autres nutriments résultant d’un apport alimentaire insuffisant. Les symptômes sont le plus souvent observés chez les enfants des pays en développement. Lorsque l’apport en protéines est exceptionnellement faible, on observe des signes physiques – retard de croissance, mauvaise musculation, œdèmes, cheveux fins et fragiles, lésions cutanées – et des modifications biochimiques, notamment un faible taux d’albumine sérique et des déséquilibres hormonaux. Les œdèmes et la perte de masse musculaire et de cheveux sont les signes les plus importants chez les adultes. Une carence de cette gravité est très rare en Europe, sauf si elle est la conséquence de conditions pathologiques et d’une mauvaise prise en charge médicale des personnes souffrant de maladies graves (7).

Photo de kroshka__nastya sur Freepik.com
Une carence en acides aminés est possible et peut être due à de nombreuses causes. Les raisons sont les suivantes (1) :
- Vieillissement
- Stress chronique
- Dépression
- Prise de médicaments (antiacides, antibiotiques, médicaments de traitement chimique)
- Régimes hypoprotidiques (les régimes pauvres en protéines)
- Alimentation peu variée
- Consommation excessive de produits industriels
- Maladies du système digestif
- Malabsorptions
- Excrétion excessive urinaire
- Déséquilibre vitaminique et minéral
- Traumatismes, brûlures, chirurgies, maladies chroniques
- Chirurgie de l’obésité.
Les besoins en acides aminés essentiels
Les besoins en acides aminés sont pris en compte avec les besoins en protéines. De plus, il est primordial de varier les sources d’alimentation afin de combler la totalité des besoins.
Les apports nutritionnels conseillés (ANC) en protéines varient selon les personnes : enfants, adultes, femmes enceintes, personnes âgées : chacun a des besoins différents. Pour un homme sédentaire sain, le besoin estimé est de 0,6 à 0,8 gramme de protéines par kg de poids corporel (8, 9). Selon les données de l’enquête INCA1 (24), l’apport moyen en protéines est de 1,4 g/kg/j. Les besoins sont donc largement couverts dans les pays développés. Les protéines devraient se situer entre 11 et 15% de la ration journalière mais en réalité elles représentent 17% (10, 11).
Certains auteurs recommandent même 2 à 3 g/kg/j pour les athlètes de force, mais des apports plus élevés (à partir de 3,5 g/kg/j) ne représentent aucun bénéfice, le surplus se transforme en résidus gras lors du catabolisme protéique. Oui, tu as bien entendu ! L’excès de protéines est stocké sous forme de graisse !
Les protéines dans les aliments courants
Teneur en protéines de certains aliments (12, 13) :
| Aliment | Quantité de protéines pour 100g |
|---|---|
| Steak haché 5% de matière grasse | 25,5g |
| Saumon cuit à la vapeur | 20,8g |
| Cabillaud | 23,1g |
| Jambon | 20,3g |
| Escalope de dinde | 24,6g |
| Œuf cru | 12,7g |
| Tofu | 9,9g |
| Escalope végétale ou steak à base de soja | 15,5g |
| Lentilles vertes cuites | 10g |
| Amandes | 25g |
| Quinoa cru | 14g |
Voici un autre tableau montrant la séquence d’acides aminés des aliments. Le quinoa, bien que d’origine végétale, se distingue par sa parfaite séquence d’acides aminés…
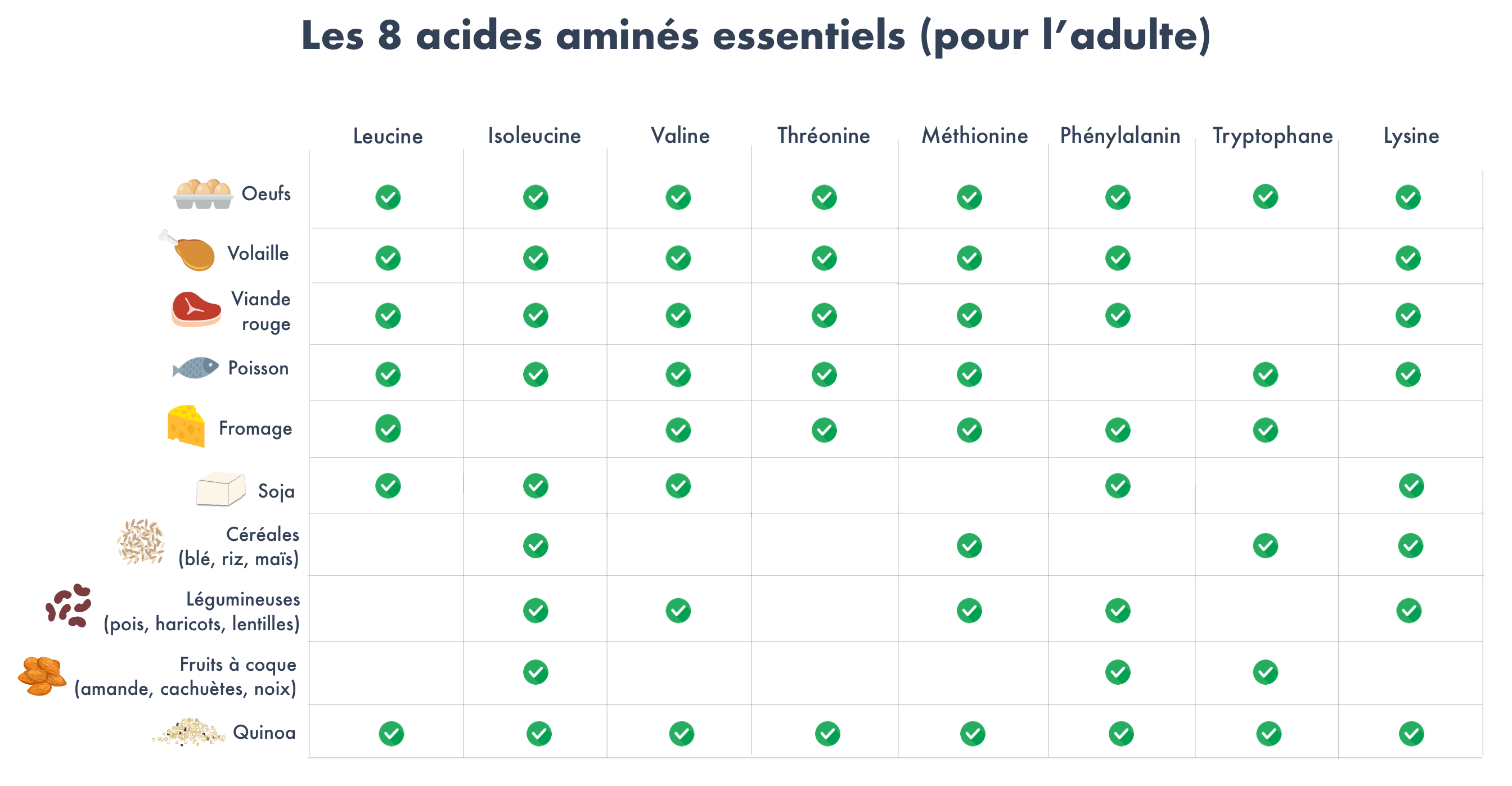
Acides aminés présents dans les aliments
Étant donné que presque aucune des protéines végétales ne fournit une séquence d’acides aminés complète, il est important de varier l’alimentation dans un régime à base de plantes.
Ceren, nutritionniste GoodSesame
Les acides aminés essentiels et leurs fonctions spécifiques
Avant d’examiner en détail chacun des acides aminés essentiels, jetons un coup d’œil à un résumé de toutes les caractéristiques générales ! En plus de servir d’éléments constitutifs des protéines, les AA jouent un rôle dans :
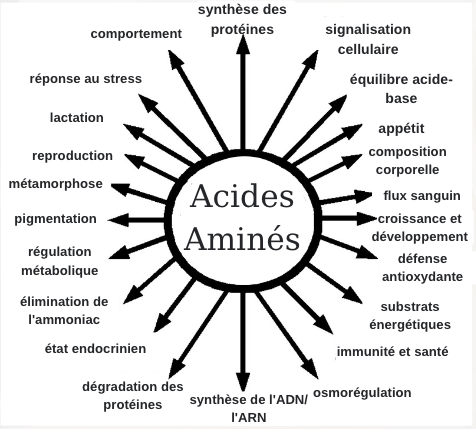
Rôles des Acides Aminés (AA) dans la nutrition et l’homéostasie (équilibre) du corps entier.
La méthionine
Le rôle essentiel de la méthionine est d’initier la synthèse des protéines (14),
Rôle d’antioxydant :
Les résidus de méthionine partagent au moins deux fonctions avec sa sœur soufrée (ces deux derniers transportent du soufre), la cystéine : défense antioxydante (14, 15) et régulation de la fonction cellulaire (16, 17, 18).
Les résidus de méthionine constituent un important mécanisme de défense antioxydant : une variété d’oxydants réagissent facilement avec la méthionine pour former du sulfoxyde de méthionine, et les résidus de méthionine exposés en surface créent une concentration extrêmement élevée de réactif, disponible comme piège à oxydants efficace. Cela signifie que la méthionine est oxydée afin que d’autres structures importantes de l’organisme ne soient pas oxydées et endommagées. Cela se produit de manière dynamique dans le corps (14-19).
Les acides aminés contenant du soufre neutralisent les radicaux libres (les oxydants). Le soufre est nécessaire à la synthèse du glutathion qui est un antioxydant l’un des plus puissants (20).
Fourniture de méthyle et muscles :
La créatine est la source d’énergie immédiate des muscles. On la synthétise à partir de la glycine, de l’arginine et grâce à un groupe méthyle provenant de la S-adénosylméthionine (SAM) qui est la forme active de la méthionine (21-23).
- Le soufre de la méthionine prend place dans la structure de la kératine. La kératine est essentielle pour la santé des cheveux, de la peau et des ongles (24).
- Les niveaux de carnitine jouent un rôle essentiel dans la production d’énergie. Ils sont corrélés à l’apport en acides aminés essentiels, méthionine et lysine (comme des substrats pour sa synthèse interne) (25, 26).

Photo de Tyler Nix sur Unsplash.com
Dépression :
Les résultats obtenus lors d’études préliminaires en double aveugle soutiennent l’hypothèse selon laquelle la forme active de méthionine peut avoir des effets antidépresseurs (27).
La lysine
Action anti inflammatoire :
Nous avons constaté que la Poli Lysine (PL) (un homopolymère de L-lysine relié par des liaisons peptiques) réduisait la sécrétion des agents inflammatoires. D’autre part, l’expression génétique de ces agents (qui s’appellent TNF-α, IL-6 et IL-1β) a été inhibée par la supplémentation en PL (C’est un effet bénéfique pour les maladies inflammatoires de l’intestin) (28).
Le virus de l’herpès simplex (HSV) : Des essais contrôlés randomisés en double aveugle ont montré que la supplémentation en lysine est efficace dans le traitement de HSV en raison de ses propriétés antivirales (29, 30).
Os & Muscles & Peau :
L’ostéoporose : La lysine favorise l’absorption du calcium et réduit l’excrétion urinaire du calcium. La supplémentation en lysine et en arginine réduit la perte osseuse et combat l’ostéoporose en augmentant la production de collagène (31).
La lysine a une fonction importante dans la constitution des liaisons entre les molécules pour construire les fibrilles et les fibres de collagène important pour la peau (32).

Photo de Joel Ambass sur Unsplash.com
Diminution de l’anxiété :
La lysine se comporte comme un antagoniste (l’opposition, l’inhibition) des récepteurs de la sérotonine, empêchant ainsi partiellement les réponses à l’anxiété (33). La carence en L-lysine est connue pour augmenter le risque d’anxiété chez les humains (34, 35).
Le tryptophane
Le tryptophane est un autre acide aminé essentiel.
Sommeil
Il est le précurseur de la sérotonine, connue sous le nom d’hormone du bonheur. Le tryptophane est transformé en sérotonine et la sérotonine en mélatonine (l’hormone du sommeil). Grâce ce dernier, la mélatonine régule le rythme biologique de l’organisme.
L’obscurité et le sommeil sont essentiels à la synthèse de la mélatonine. Le tryptophane est un activateur de la sérotonine et de l’hormone neurosécrétoire mélatonine pour le sommeil/éveil (36).
Stress-Anxiété – Dépression :
Une carence alimentaire en L-tryptophane, L-phénylalanine ou L-tyrosine entraîne une faible synthèse de sérotonine en raison du manque de disponibilité de ces éléments constitutifs et cette carence alimentaire est associée à l’anxiété (37-39).
On sait que la supplémentation alimentaire en L-tryptophane augmente la synthèse de la sérotonine chez les rats et les humains (37, 38, 40), ce qui confirme une approche nutritionnelle du traitement de l’anxiété. Le 5-hydroxytryptophane (5-HTP), (le précurseur du tryptophane), augmente les niveaux de sérotonine synthétisée chez les humains (41, 42). Le 5-HTP et le tryptophane augmentent les niveaux de sérotonine dans le cerveau et sont connus pour améliorer le sentiment de bien-être (43-45).
Enfin, l’augmentation de l’apport en tryptophane du cerveau favorise la synthèse et la libération de la sérotonine. Amélioration de l’anxiété et des troubles du comportement sont dus à une carence en sérotonine (46, 47).
L’insuline (l’hormone que nous sécrétons après avoir consommé notamment des glucides) provoque le passage dans le tissu musculaire des acides aminés leucine, isoleucine, valine, avec lesquels le Tryptophane est en compétition dans le sang lorsqu’il passe dans le tissu cérébral, et la concentration sanguine de Tryptophane augmente.
Pour cette raison, les glucides qui augmentent rapidement l’insuline et les sucreries et le chocolat à forte teneur en tryptophane provoquent le bonheur.

Photo de Jacqueline Munguia sur Unsplash.com
BCAA (Acides aminés à chaîne ramifiée)
Leucine, Isoleucine, Valine : Impliqués dans la synthèse des protéines, l’énergie et le métabolisme du stress. Les BCAA peuvent réguler le taux de synthèse et de dégradation des protéines dans les muscles et les autres organes.
Humeur
Ils agissent sur l’état psychologique. Les BCAA et les autres acides aminés (AA) se lient aux mêmes protéines porteuses pour être transportés vers le cerveau. Ils sont en compétition les uns avec les autres et leur ratio dans le cerveau. Cela peut influencer la synthèse de neurotransmetteurs spécifiques (les messagers), ce qui peut influencer le comportement d’un organisme (49, 50).
Fatigue
Les BCAA ont une action de régulation du glycogène (les réserves de glucose dans le corps) et ont une relation inverse avec les niveaux de tryptophane dans le cerveau qui est le précurseur de la sérotonine. La sérotonine est un médiateur de la fatigue centrale. Ainsi, une supplémentation en BCAA peut prévenir la fatigue lors d’un exercice intense, et un régime enrichi en BCAA peut améliorer le métabolisme des protéines musculaires, le maintien de l’organisme, ainsi que l’exercice aérobie (50, 51). En termes simples, pendant l’exercice, les BCAA passent dans le muscle et cessent d’entrer en compétition avec le tryptophane. Ainsi, chacun fait son travail !
Muscles
Ils augmentent la masse musculaire, la force musculaire et l’endurance. De plus, ils améliorent la récupération après l’exercice. Ils sont donc importants pour la croissance et la réparation des os et des muscles.
Source d’énergie
Les BCAA ont un meilleur rendement énergétique que le glucose. Par exemple, l’oxydation complète de la leucine dans le muscle produit plus d’énergie que l’utilisation complète du glucose sous forme d’énergie (52)
Synthèse des protéines
On observe également que les BCAA régulent le renouvellement des protéines dans les muscles en inhibant la dégradation des protéines et en favorisant leur synthèse (53-55).
Performance
On a également constaté que la supplémentation en protéines enrichies en BCAA est bénéfique chez les animaux et les humains en augmentant la performance à l’effort (52).

Photo de Jonathan Chng sur Unsplash.com
Immunité
Les trois BCAA sont absolument nécessaires à la croissance et à la prolifération des lymphocytes (nos agents de lutte contre les organismes pathogènes). Les BCAA sont également importants pour l’activité des lymphocytes T cytotoxiques et des cellules tueuses naturelles (encore, agents bénéfiques de notre système immunitaire) (56).
Une étude humaine (57) sur des patients ayant subi une intervention chirurgicale montre qu’une supplémentation accrue en BCAA entraîne une augmentation des lymphocytes sanguins postopératoires, des paramètres immunitaires plus élevés et une meilleure récupération. Bassit et al. (58) ont observé ses effets bénéfiques sur des triathlètes d’élite masculins concernant les paramètres immunitaires.
Diabète
Ils régulent le taux sanguin de sucre, leur ratio dans le sang augmente en cas de résistance à l’insuline et de diabète.
Il existe une forte corrélation entre les BCAA circulants et la prédiction du diabète (58). Dans une étude récente, il a été constaté que les patients atteints de diabète de type 2, qui présentaient une altération de la glycémie à jeun (taux de sucre sanguin), avaient également des niveaux élevés de BCAA par rapport aux individus sains (59, 52).
Enfin, une augmentation du taux sanguin de BCAA est associée à un risque élevé de trouble métabolique et de résistance à l’insuline future, ou de diabète de type 2 (60).
Que déclare l’EFSA sur les BCAA ?
 L’EFSA (Autorité européenne de sécurité des aliments) effectue des évaluations scientifiques afin de contribuer à garantir que les allégations nutritionnelles et de santé figurant sur l’étiquetage et la publicité des denrées alimentaires sont pertinentes et correctes, et peuvent ainsi aider les consommateurs à faire des choix alimentaires sains. Elle commence donc à autoriser certaines allégations de santé sur les nutriments. Il y a aussi certaines allégations de santé que l’EFSA permet (61), par exemple, sur les BCAA ! Examinons-les ensemble !
L’EFSA (Autorité européenne de sécurité des aliments) effectue des évaluations scientifiques afin de contribuer à garantir que les allégations nutritionnelles et de santé figurant sur l’étiquetage et la publicité des denrées alimentaires sont pertinentes et correctes, et peuvent ainsi aider les consommateurs à faire des choix alimentaires sains. Elle commence donc à autoriser certaines allégations de santé sur les nutriments. Il y a aussi certaines allégations de santé que l’EFSA permet (61), par exemple, sur les BCAA ! Examinons-les ensemble !
Croissance ou maintien de la masse musculaire
Les effets allégués sont : « réduction la dégradation des protéines après l’exercice », « augmentation la synthèse des protéines », « récupération/augmentation de la synthèse des protéines dans les muscles squelettiques pendant la récupération après un exercice de force prolongé » et « métabolisme musculaire ». La population cible est considérée comme étant la population générale.
Atténuation du déclin de la puissance musculaire
L’effet revendiqué est « atténue le déclin de la puissance produite après un exercice en haute altitude ».
La population cible est considérée comme étant des personnes actives effectuant un entraînement en haute altitude.
Récupération plus rapide de la fatigue musculaire après l’exercice
Les effets allégués sont « métabolisme musculaire » et « favorise la récupération musculaire après l’exercice ».
On considère que la population cible est constituée de personnes actives dans la population générale.
Amélioration de la fonction cognitive après l’exercice
L’effet allégué est « améliore la performance mentale après l’exercice ». Le Comité suppose que la population cible est constituée d’individus actifs dans la population générale. La fonction cognitive comprend la mémoire, l’attention (concentration), l’apprentissage, l’intelligence et la résolution de problèmes, qui sont des concepts bien définis et peuvent être mesurés par des tests cognitifs psychométriques validés.
Réduction de l’effort perçu pendant l’exercice
L’effet revendiqué est le suivant : « Les BCAA améliorent la performance pendant un exercice soutenu ». Le Comité considère que la population cible est constituée d’individus actifs dans la population générale.
La phénylalanine
Stress
Elle permet la synthèse de la dopamine (dans un premier temps) et l’adrénaline et la noradrénaline (dans un second temps). Ces trois neurotransmetteurs contribuent au bon fonctionnement du système nerveux et hormonal. Ils agissent par ce biais sur les troubles de l’humeur, l’amélioration de la concentration et de la vigilance et, ainsi, sur le bien-être général (62).
Fatigue
De plus, la phénylalanine en favorisant la sécrétion d’hormones telles que la dopamine et en stimulant le système nerveux central, présente un intérêt dans une stratégie « anti-fatigue ». En effet, la dopamine en agissant sur la motivation, la concentration et le mouvement, est un neurotransmetteur favorisant le tonus et la vitalité (63).
Peau
La phénylalanine est impliquée dans la synthèse de la mélanine. La mélanine est fabriquée par les cellules situées au plus profond de l’épiderme. Elle est retrouvée dans la peau, les cheveux et les yeux. Elle joue un rôle photo protecteur contre les rayonnements ultraviolets du soleil, qui accentuent le processus de vieillissement (64).

Photo de Autumn Goodman sur Unsplash.com
L’Histidine
Antioxydant
L’histidine a montré une activité antioxydante, empêchant la glycation et la lipoxydation (dommages des lipides) qui sont des marqueurs de stress oxydatif (dommages des cellules) (65).
Allergies & Immunité
Elle est utilisée pour soigner les états allergiques, car elle est un antagoniste de l’histamine (agent du système immunitaire et marqueur d’allergie) (66).
Performance musculaire
Une supplémentation pourrait améliorer la fatigue lors de l’effort sportif (67).
Inflammations digestives chroniques
Il a été démontré que les maladies inflammatoires de l’intestin, telles que la maladie de Crohn et la rectocolite hémorragique, pouvaient être influencées par positivement l’administration d’histidine (68).
Dermatite atopique (eczéma)
Une dermatite atopique (eczéma) et une diminution des taux d’histamine dans le plasma et l’urine sont fréquemment observés chez les sujets déficients en histamine (69).
Fatigue mentale
Un essai croisé en double aveugle, contrôlé par placebo, a permis une amélioration de la sensation de fatigue avec l’administration de l’histidine lors des tâches de mémoire de travail, chez des personnes souffrant de fatigue et de perturbation du sommeil (70).

Photo de Kinga Cichewicz sur Unsplash.com
La thréonine
Immunité :
La thréonine (L-Thr) stimule le système immunitaire en participant à la production des anticorps (71).
Des informations montrent que la thréonine peut avoir un effet actif sur les systèmes de défense antioxydants et qu’il est l’un des acides aminés qui transportent une petite fraction du cuivre dans le sang (72). Par conséquent, un niveau alimentaire approprié de L-Thr peut contribuer à la capacité antioxydante (73).
Digestion
La thréonine participe activement à la digestion au niveau de l’absorption des nutriments dans le sang.
Par rapport aux autres acides aminés essentiels, la teneur en L-Thr dans les protéines de l’intestin représente jusqu’à 30% ce qui révèle que la thréonine peut contribuer à la fonctionnalité et au maintien de l’intestin (74).
Utile en cas de troubles intestinaux et d’indigestion, la thréonine a également été utilisée pour soulager l’anxiété et la dépression légère (75, 72).
Recettes
Voici 3 idées recettes savoureuses et riches en acides aminés essentiels !
Chez GoodSesame on te propose des menus sains, gourmands et respectueux de l’environnement, alors n’hésite pas à télécharger l’app !
Les études & informations sur la nutrition t’intéressent ? Pourquoi ne pas jeter un œil à notre article « L’alimentation pour la fatigue et le sommeil » ?
Si l'envie te prend de rejoindre la discussion, viens nous dire hello sur Discord et sur nos groupes Facebook privés : Santé et Nutrition, Environnement, Cuisine et Éthique et bien-être animal.
Suis-nous
Retrouve-nous sur les réseaux sociaux
Newsletter
Abonne-toi : 0% de spam et 100% de tendances !
Crédit photo de couverture : Master1305 provenant de Freepik.com
Sources :
- Aydın Duygu, Dr. Acides Aminés, 2e édition, (2017), Istanbul Tıp kitabevleri. Aydin, Dr Acide aminé essentiels,
- Janaway, R. C., Percival, S. L., & Wilson, A. S. (2009). Decomposition of Human Remains. In S. L. Percival (Éd.), Microbiology and Aging : Clinical Manifestations (p. 313‑334). Humana Press. https://doi.org/10.1007/978-1-59745-327-1_14
- Textbook of medical physiology / Arthur C. Guyton, John E. Hall.-11th ed. ISBN 0-7216-0240-1
- Lieberman M. Marks’ Basic Medical Biochemistry Fourth, North American Edition Edition Lippincott Williams & Wilkins 2013
- Richard S. Ed. Lord Laboratory Evaluations for Integrative and Functional Medicine 2nd Edition Metametrix Institute, 2008
- https://jdidcott999.wordpress.com/cell-division-genes-prontiens/
- Allowances, N. R. C. (US) S. on the T. E. of the R. D. (1989). Protein and Amino Acids. In Recommended Dietary Allowances : 10th Edition. National Academies Press (US). https://www.ncbi.nlm.nih.gov/books/NBK234922/
- AFSSA. Apport en protéines : consommation, qualité, besoins et recommandations. 2007 p. 461.
- ANSES. Actualisation des repères du PNNS : élaboration des références nutritionnelles. 2016 p. 329.
-
AFSSA. Etude Individuelle Nationale des Consommations Alimentaires 2 (INCA2 ). 2009.
- ANSES. Etude individuelle nationale des consommations alimentaires 3 (INCA 3). 2017 p. 566.
- Bouget, C. (s. d.). Protéines et acides aminés : Utilisations par les sportifs et conseils à l’officine. 152
- Ciqual Table de composition nutritionnelle des aliments [Internet]. Disponible sur: https://ciqual.anses.fr/
- Levine, R., Moskovitz, J., & Stadtman, E. (2001). Oxidation of Methionine in Proteins : Roles in Antioxidant Defense and Cellular Regulation. IUBMB Life, 50(4), 301‑307. https://doi.org/10.1080/713803735
- Levine, R. L., Mosoni, L., Berlett, B. S., and Stadtman, E. R. (1996) Methionine residues as endogenous antioxidants in proteins. Proc. Natl. Acad. Sci. USA 93, 15036–15040. 2. Gonias, S. L., Swaim, M. W.,
- Massey, M. F., and Pizzo, S. V. (1988) cisdichlorodiammineplatinum (II) as a selective modi er of the oxidationsensitive reactive-center methionine in alpha 1-antitrypsin. J. Biol. Chem. 263, 393–397.
- Brot, N., and Weissbach, H. (1991) Biochemistry of methionine sulfoxide residues in proteins. BioFactors 3, 91–96.
- Vogt, W. (1995) Oxidation of methionine residuesin proteins: Tools, targets, and reversal. Free Radic. Biol. Med. 18, 93–105.
- Luo, S., & Levine, R. L. (2009). Methionine in proteins defends against oxidative stress. The FASEB Journal, 23(2), 464‑472. https://doi.org/10.1096/fj.08-118414
-
Reed, D. J., & Orrenius, S. (1977). The role of methionine in glutathione biosynthesis by isolated hepatocytes. Biochemical and Biophysical Research Communications, 77(4), 1257‑1264. https://doi.org/10.1016/S0006-291X(77)80115-0
- da Silva, R. P., Nissim, I., Brosnan, M. E., & Brosnan, J. T. (2009). Creatine synthesis : Hepatic metabolism of guanidinoacetate and creatine in the rat in vitro and in vivo. American Journal of Physiology-Endocrinology and Metabolism, 296(2), E256‑E261. https://doi.org/10.1152/ajpendo.90547.2008
- Du Vigneaud, V., Cohn, M., Chandler, J. P., Schenck, J. R., & Simmonds, S. (1941). The utilization of the methyl group of methionine in the biological synthesis of choline and creatine. Journal of Biological Chemistry, 140, 625‑641.
- Brosnan, J. T., Brosnan, M. E., Bertolo, R. F. P., & Janet A. Brunton. (2007). Methionine : A metabolically unique amino acid. Livestock Science, 112(1), 2‑7. https://doi.org/10.1016/j.livsci.2007.07.005
- Haneke, E., & Baran, R. (2011). Micronutrients for Hair and Nails. In J. Krutmann & P. Humbert (Éds.), Nutrition for Healthy Skin : Strategies for Clinical and Cosmetic Practice (p. 149‑163). Springer. https://doi.org/10.1007/978-3-642-12264-4_14
- Krajcovicová-Kudlácková, M., Simoncic, R., Béderová, A., Babinská, K., & Béder, I. (2000). Correlation of carnitine levels to methionine and lysine intake. Physiological Research, 49(3), 399‑402.
- Tanphaichitr, V., & Leelahagul, P. (1993). Carnitine metabolism and human carnitine deficiency. Nutrition (Burbank, Los Angeles County, Calif.), 9(3), 246‑254.
- Papakostas, G. I., Alpert, J. E., & Fava, M. (2003). S-adenosyl-methionine in depression : A comprehensive review of the literature. Current Psychiatry Reports, 5(6), 460‑466. https://doi.org/10.1007/s11920-003-0085-2
- Mine, Y., & Zhang, H. (2015). Anti-inflammatory Effects of Poly-l-lysine in Intestinal Mucosal System Mediated by Calcium-Sensing Receptor Activation. Journal of Agricultural and Food Chemistry, 63(48), 10437‑10447. https://doi.org/10.1021/acs.jafc.5b03812
- Griffith RS. Success of L-lysine therapy in frequently recurrent Herpes simplex infection. Treatment and prophylaxis. Dermatologica. 1987;175:183-190.
-
Milan N. Lysine prophylaxis in recurrent Herpes simplex labialis: a double-blind, controlled crossover study. Acta Derm Venereol. 1980;60:85-87.
- Civitelli R. Dietary L-lysine and calcium metabolism in humans. Nutrition 1992;8:400-405.
- Frey J, Raby N. Lysine et collagène [Lysine and collagen]. Ann Biol Clin (Paris). 1991;49(1):36-9. French. PMID: 1904695.
- Smriga M, Torii K. L-Lysine acts like a partial serotonin receptor 4 antagonist and inhibits serotonin-mediated intestinal pathologies and anxiety in rats. Proc Natl Acad Sci U S A. 2003 Dec 23;100(26):15370-5. doi: 10.1073/pnas.2436556100. Epub 2003 Dec 15. PMID: 14676321; PMCID: PMC307574.
- Ghosh S, Smriga M, Vuvor F, et al. Effect of lysine supplementation on health and morbidity in subjects belonging to poor peri-urban households in Accra, Ghana. Am J Clin Nutr. 2010;92(4):928–39.
- Smriga M, Ghosh S, Mouneimne Y, et al. Lysine fortification reduces anxiety and lessens stress in family members in economically weak communities in Northwest Syria. Proc Natl Acad Sci USA. 2004;101(22):8285–88.
- Jones BE. Neurobiology of waking and sleeping. Handb Clin Neurol. 2011;98:131–49
- Hood SD, Hince DA, Davies SJ, et al. Effects of acute tryptophan depletion in serotonin reuptake inhibitor-remitted patients with generalized anxiety disorder. Psychopharmacology (Berl) 2010;208(2):223–32.
- Toker L, Amar S, Bersudsky Y, et al. The biology of tryptophan depletion and mood disorders. Isr J Psychiatry Relat Sci. 2010;47(1):46–55.
- Roiser JP, Levy J, Fromm SJ, et al. The effect of acute tryptophan depletion on the neural correlates of emotional processing in healthy volunteers. Neuropsychopharmacology. 2008;33(8):1992–2006.
-
Feurté S, Gerozissis K, Regnault A, Paul FM. Plasma Trp/LNAA ratio increases during chronic ingestion of an alpha-lactalbumin diet in rats. Nutr Neurosci. 2001;4(5):413–18.
- Trachte GJ, Uncini T, Hinz M. Both stimulatory and inhibitory effects of dietary 5-hydroxytryptophan and tyrosine are found on urinary excretion of serotonin and dopamine in a large human population.acides aminés essentiels Neuropsychiatr Dis Treat. 2009;5:227–35.
- . Croonenberghs J, Verkerk R, Scharpe S, et al. Serotonergic disturbances in autistic disorder: L-5-hydroxytryptophan administration to autistic youngsters increases the blood concentrations of serotonin in patients but not in controls. Life Sci. 2005;76(19):2171–83.
- Young SN, Leyton M. The role of serotonin in human mood and social interaction. Insight from altered tryptophan levels. Pharmacol Biochem Behav. 2002;71(4):857–65.
- Lakhan SE, Vieira KF. Nutritional therapies for mental disorders. Nutr J. 2008;7:2.
- Markus CR. Dietary amino acids and brain serotonin function; implications for stress-related affective changes. Neuromolecular Med. 2008;10(4):247-58.
- Lindseth G. The effects of dietary tryptophan on affective disorders. Arch Psychiatr Nurs. 2015Apr;29(2):102-7
- Schneider-Helmert D. Evaluation of L-tryptophan for treatment of insomnia: a review. Psychopharmacology (Berl). 1986;89:1-7
- Mawson, A. R., & Jacobs, K. W. (1978). Corn consumption, tryptophan, and cross-national homicide rates. Journal of Orthomolecular Psychiatry. https://scholar.google.com/scholar_lookup?title=Corn+consumption%2C+tryptophan%2C+and+cross-national+homicide+rates&author=Mawson%2C+A.R.&publication_year=1978
- B. Skeie, V. Kvetan, K. M. Gil, M. M. Rothkopf, E. A. Newsholme, and J. Askanazi, “Branch-chain amino acids: their metabolism and clinical utility,” Critical Care Medicine, vol. 18, no. 5, pp. 549–571, 1990.
-
J. D. Fernstrom, “Branched-chain amino acids and brain function,” Journal of Nutrition, vol. 135, supplement 6, pp. 1539S– 1546S, 2005.
- H. Kainulainen, J. J. Hulmi, and U. M. Kujala, “Potential role of branched-chain amino acid catabolism in regulating fat oxidation,” Exercise and Sport Sciences Reviews, vol. 41, no. 48, pp. 194–200, 2013.
- Monirujjaman, Md., & Ferdouse, A. (2014). Metabolic and Physiological Roles of Branched-Chain Amino Acids. Advances in Molecular Biology, 2014, 1‑6. https://doi.org/10.1155/2014/364976
- H. R. Freund and M. Hanani, “The metabolic role of branchedchain amino acids,” Nutrition, vol. 18, no. 3, pp. 287–288, 2002.
- A. L. Goldberg and R. Odessey, “Oxidation of amino acids by diaphragms from fed and fasted rats.,” The American Journal of Physiology, vol. 223, no. 6, pp. 1384–1391, 1972.
- M. G. Buse and S. S. Reid, “Leucine: a possible regulator of protein turnover in muscle,” Journal of Clinical Investigation, vol. 56, no. 5, pp. 1250–1261, 1975.
- P. C. Calder, “Branched-chain amino acids and immunity,” The Journal of Nutrition, vol. 136, supplement 1, no. 1, pp. 288S–293S, 2006.
- F. B. Cerra, J. E. Mazuski, E. Chute et al., “Branched chain metabolic support. A prospective randomized, double-blind trial in surgical stress,” acides aminés essentielsAnnals of Surgery, vol. 199, no. 3, pp. 286– 291, 1984. R. A. Bassit, L. A. Sawada, R. F. P. Bacurau et al., “Branchedchain amino acid supplementation and the immune response of long-distance athletes,” Nutrition, vol. 18, no. 5, pp. 376–379, 2002.
- B. C. Batch, K. Hyland, and L. P. Svetkey, “Branch chain amino acids: biomarkers of health and disease,” Current Opinion in Clinical Nutrition and Metabolic Care, vol. 17, no. 1, pp. 86–89, 2014.
- F. Xu, S. Tavintharan, C. F. Sum, K. Woon, S. C. Lim, and C. N. Ong, “Metabolic signature shift in type 2 diabetes mellitus revealed by mass spectrometry-based metabolomics,” Journal of Clinical Endocrinology and Metabolism, vol. 98, no. 6, pp. E1060–E1065, 2013.
-
Yoon, M.-S. (2016). The Emerging Role of Branched-Chain Amino Acids in Insulin Resistance and Metabolism. Nutrients, 8(7), 405. https://doi.org/10.3390/nu8070405
- EFSA Panel on Dietetic Products, Nutrition and Allergies (NDA). (2010). Scientific Opinion on the substantiation of health claims related to branched-chain amino acids (BCAA) and growth or maintenance of muscle mass (ID 442, 444, 445, 447, 448, 451, 1478), attenuation of the decline in muscle power following exercise at high altitude (ID 443), faster recovery from muscle fatigue after exercise (ID 447, 448, 684,1478), improvement of cognitive function after exercise (ID 446), reduction in perceived exertion during exercise (ID 450) and “healthy immune system” (ID 449) pursuant to Article 13(1) of Regulation (EC) No 1924/2006. EFSA Journal, 8(10), 1790. https://doi.org/10.2903/j.efsa.2010.1790
- Beckmann, H., M.A. Strauss, and E. Ludolph, Dl-phenylalanine in depressed patients: an open study. J Neural Transm, 1977. 41(2-3): p. 123-34.
- Cordeiro, L.M.S., et al., Physical exercise-induced fatigue: the role of serotonergic and dopaminergic systems. Braz J Med Biol Res, 2017. 50(12): p. e6432.
- Slominski, A., M.A. Zmijewski, and J. Pawelek, L-tyrosine and L-dihydroxyphenylalanine as hormone-like regulators of melanocyte functions. Pigment Cell Melanoma Res, 2012. 25(1): p. 14-27.
- Scavenging of singlet molecular oxygen by imidazole compounds: high and sustained activities of carboxy terminal histidine dipeptides and exceptional activity of imidazole-4-acetic acid 1990
- The therapeutic use of the amino acid histidine in allergy and shock—acides aminés essentiels “Histidine as a factor in histamine epinephrine balance” 1944
- Determinants of muscle carnosine content 2012
- (Smoothie 4) Dietary histidine ameliorates murine colitis by inhibition of proinflammatory cytokine production from macrophages 2009
-
Evidence that histidine is an essential amino acid in normal and chronically uremic man 1975
- The effect of histidine on mental fatigue and cognitive performance in subjects with high fatigue and sleep disruption scores 2015
- Saadatmand N., Toghyani M., Gheisari A. Effects of dietary fiber and threonine on performance, intestinal morphology and immune responses in broiler chickens. Anim. Nutr. 2019;5:248–255.
- Aydın Duygu, Dr. Acides Aminés, 2e édition, (2017), Istanbul Tıp kitabevleri. Aydin, Dr Acide aminé,
- Li, J. M., Zhang, X. Y., Yuan, C., Miao, L. P., Yan, H. X., Dong, X. Y., Lu, J. J., & Zou, X. T. (2016). Effects of dietary L-threonine levels on antioxidant capacity, digestive enzyme activities, and antibody production of Xinyang green-shell laying hens. Journal of Applied Poultry Research, 25(3), 422‑427. https://doi.org/10.3382/japr/pfw028
- M.R. Neutra, J.F. Forstner Gastrointestinal mucus: Synthesis, secretion and function L.R. Johnson (Ed.), Physiology of the Gastrointestinal Tract (2nd ed.), Raven Press, New York (1987), pp. 975-1009
- PubChem. (s. d.). L-Threonine. Consulté 28 juin 2022, à l’adresse https://pubchem.ncbi.nlm.nih.gov/compound/6288


https://indiamedshub.com/# mail order pharmacy india
http://expresscarerx.org/# ExpressCareRx
buy from mexico pharmacy accutane mexico buy online MediMexicoRx
ExpressCareRx: viagra online pharmacy reviews – provera online pharmacy
IndiaMedsHub: pharmacy website india – reputable indian online pharmacy
http://indiamedshub.com/# indianpharmacy com
MediMexicoRx get viagra without prescription from mexico tadalafil mexico pharmacy
order from mexican pharmacy online: legit mexico pharmacy shipping to USA – MediMexicoRx
http://expresscarerx.org/# ExpressCareRx
https://indiamedshub.shop/# mail order pharmacy india
¿Hola aficionados al riesgo ?
Casas de apuestas fuera de España ofrecen recompensas aleatorias llamadas “drops”, que se activan mientras juegas sin previo aviso. Puedes ganar desde giros gratis hasta bonos de saldo por sorpresa. [url=http://casasdeapuestasfueradeespana.guru/#]casasdeapuestasfueradeespana[/url]Esto convierte cada sesión en una oportunidad inesperada.
Casas de apuestas extranjeras ofrecen juegos con grГЎficos de Гєltima generaciГіn sin necesidad de descargar software pesado. Solo entras y juegas desde el navegador. Esto reduce barreras tГ©cnicas de acceso.
Casasdeapuestasfueradeespana.guru: beneficios exclusivos – http://casasdeapuestasfueradeespana.guru/#
¡Que disfrutes de enormes logros !
jak się nazywa aktor grający Toma? Nie daje mi to spokoju :c 100% bezpieczne 100% bezpieczne MAKIJAŻ do -50%! Eveline Cosmetics, Paese, Claresa, Kiko Milano i wiele innych Obsługa Javascript w Twojej przeglądarce jest wyłączona. Włącz go, aby móc w pełni wykorzystać możliwości tej witryny. Obsługa Javascript w Twojej przeglądarce jest wyłączona. Włącz go, aby móc w pełni wykorzystać możliwości tej witryny. MAKIJAŻ do -50%! Eveline Cosmetics, Paese, Claresa, Kiko Milano i wiele innych 100% bezpieczne Obsługa Javascript w Twojej przeglądarce jest wyłączona. Włącz go, aby móc w pełni wykorzystać możliwości tej witryny. DARMOWA DOSTAWA PRZEZ INPOST PACZKOMAT® 24 7 OD 15 ZŁ Obsługa Javascript w Twojej przeglądarce jest wyłączona. Włącz go, aby móc w pełni wykorzystać możliwości tej witryny.
https://www.proweboldal.hu/2025/07/16/betonred-polska-legalny-bukmacher-na-polskim-rynku/
O down load do jogo é rápido e fácil de hacer, garantindo la cual operating system jogadores possam acessar teus jogos favoritos continuamente o qual desejarem, sem a necessidade de acesso à internet. Optei durante pesquisar cependant jogos de uma Matter-of-fact Have fun pois a provedora accede que os cassinos on the internet decidam o Auto-generated excerpt Home » 888starz bd Home » 1Win AZ Casino Join the community of enthusiastic players and dive into the exhilarating world of Aviator APK. With a simple download, you can start your journey to uncover the secrets of the skies and potentially walk away with massive wins! Click the link below to start your adventure today! Your bank account merely needs for adequate money to experience the new specific position games you’ve chosen. You can trust you to definitely casinos offering which incentive have been in existence for a time and therefore are legitimate. You could think this refers to a lot of the on the internet casinos, but one to’s untrue. There are a few what to remember while you look for an established, feature-rich internet casino.
cheap cialis mexico tadalafil mexico pharmacy buy meds from mexican pharmacy
indian pharmacy online: reputable indian pharmacies – IndiaMedsHub
IndiaMedsHub: IndiaMedsHub – buy prescription drugs from india
mostbet az etibarlıdırmı mostbet4055.ru
http://tryggmed.com/# salpeter apotek
mostbet jonli kazino [url=https://www.mostbet4071.ru]mostbet jonli kazino[/url]
как вывести бонусные деньги с мелбет как вывести бонусные деньги с мелбет
cbd olja apotek: Snabb Apoteket – apotek on line
med apotheek: onl8ne drogist – apotheker online
https://snabbapoteket.com/# lediga jobb apotek
https://zorgpakket.shop/# medicijnen kopen zonder recept
como funciona 1win [url=https://1win3045.com/]https://1win3045.com/[/url]
ставки на хоккей прогнозы http://prognozy-na-khokkej-segodnya.ru/ .
mijn medicijnkosten: medicaties – medicijnen bestellen apotheek
online apotheken ons medicatie voor apotheken inloggen apotheek
работающее зеркало мелбет [url=www.melbet3003.com]работающее зеркало мелбет[/url]
https://zorgpakket.com/# farmacia online
online apotheek recept: MedicijnPunt – mediceinen
мелбет официальный сайт http://melbet3007.com
videos 1win videos 1win
888starz download apk [url=https://888starz.fans]888starz download apk[/url] .
promilletester apotek: TryggMed – ГҐpningstider apotek
спортивные прогнозы на спорт спортивные прогнозы на спорт .
http://zorgpakket.com/# medicijnlijst apotheek
medicijnen op recept Medicijn Punt medicijnlijst apotheek
прогноз на футбол https://prognozy-na-futbol-1.ru/ .
farma: Medicijn Punt – online medicatie bestellen
https://zorgpakket.com/# online medicijnen kopen zonder recept
medicijne: MedicijnPunt – antibiotica kopen zonder recept
http://snabbapoteket.com/# nageltrång apotek
glassflaske med pipette apotek apotek pГҐ nett glidemiddel apotek
pharma online: farmacie medicijn – apotheek spanje online
мелбет kz мелбет kz
betrouwbare online apotheek zonder recept: recept medicijn – medicijnen snel bestellen
http://snabbapoteket.com/# glasögon online billigt
l-serin apotek: hosta pГҐ engelska – snabbtest covid apotek
body hund apotek glasögon online billigt apotek öppettider
https://tryggmed.shop/# apotek solkrem
https://tryggmed.shop/# pulsoksymeter apotek
hГ¶rapparat rГ¶d blГҐ: SnabbApoteket – graviditetstest billigt
13WIN is a premier and trusted online betting platform offering over 2,000 exciting games — from sports betting and live casino to slots, fish shooting, and lottery. With a user-friendly Vietnamese interface, fast deposits and withdrawals (within 5–15 minutes), and attractive promotions, 13WIN caters to all entertainment needs of Vietnamese players.
Fully licensed and highly secure, 13WIN is committed to providing a legal, transparent, safe, and responsible betting experience.
kan man ta ut resept pГҐ alle apotek: Trygg Med – bodylotion apotek
online medicijnen bestellen zonder recept Medicijn Punt recept medicijnen
Puedes empezar a jugar a Tower Rush en Android inmediatamente después de descargar la aplicación móvil en tu teléfono desde la tienda de aplicaciones Play Market. Pero si no encuentras la aplicación del casino allí, significa que la tienda la ha retirado. Esto ocurre a menudo, ¡pero los sitios de juego tienen una solución! Para jugar a Tower Rush en Android, sigue estos pasos: En plataformas como 1win TowerRush, es común encontrar promociones dedicadas solo a este título. Estas ofertas pueden incluir tiradas gratis, multiplicadores o reembolsos limitados al juego de Tower Rush online. Sin embargo, no todos los bonos aplican automáticamente; algunos requieren activación manual o el ingreso de un código específico al momento del registro. Rush Royale es un tower defense competitivo en el que dos jugadores tendrán que enfrentarse a oleadas interminables de enemigos, con el objetivo de sobrevivir más tiempo que su rival. Para ello, además, en lugar de torres podremos usar guerreros y magos, que podremos ir combinando y subiendo de nivel.
https://hargakarpetbadminton.dinarway.com/uncategorized/resena-del-juego-balloon-de-smartsoft-para-jugadores-venezolanos/
Las cookies son pequeños archivos donde se almacena información que se instala en tu navegador o dispositivo. Esta información se guarda para próximas visitas que realices en Amimir ya que, registra la actividad del usuario durante el tiempo de navegación (por ejemplo, fecha de la última visita, preferencias de navegación, etc), esto se utiliza para agilizar la navegación del usuario. Perfil de Knuckles en Sonic Generations. Uno de los permisos que puedes controlar es el del acceso a tu ubicación. Pero en este caso no sólo hay muchas aplicaciones que pueden acceder a ella, sino que el propio Google también puede irlo registrando. Una de las maneras de evitarlo es desconectar el GPS del móvil, aunque si luego quieres utilizar los mapas u otra app similar deberás activarlos temporalmente. Para hacerlo, entra en la aplicación de Ajustes, y pulsa en Seguridad y ubicación.
donde comprar antibiotico sin receta: Clinica Galeno – se puede comprar medicamentos con receta de otro paГs
1win colombia http://www.1win3048.com
http://ordinasalute.com/# keforal 500 per cani prezzo
eutirox prezzo senza ricetta OrdinaSalute easotic cane prezzo
1win aviator demo https://1win3046.com
etoricoxib prezzo: cardiazol paracodina prezzo – resilient 83 mg prezzo
1win hesabı bərpa etmək [url=http://1win3038.com/]1win hesabı bərpa etmək[/url]
http://pharmadirecte.com/# malarone ordonnance
lorans principio attivo OrdinaSalute tachifene 500
https://pharmadirecte.shop/# atovaquone prix
la vitamina d se puede comprar sin receta: farmacia online candidiasis – se puede comprar espidifen sin receta mГ©dica
1win peliculas [url=https://www.1win3044.com]https://www.1win3044.com[/url]
https://pharmadirecte.com/# faire un ecbu sans ordonnance
augmentin prezzo di base 10000 gocce gentalyn beta prezzo senza ricetta
мелбет казино официальный сайт скачать https://melbet3002.com/
farmacia felicia online: donde comprar fluconazol sin receta chile – los antidepresivos se pueden comprar sin receta
1win aviator hack [url=https://1win3043.com]https://1win3043.com[/url]
https://pharmadirecte.shop/# malarone prix moins cher
Durante as jogadas grátis da Sweet Bonanza, a mecânica de cascata continua ativa da mesma forma que no jogo base, mas entra em cena um elemento extra: os símbolos multiplicadores, também conhecidos como “bombas doces”. Cada bomba multiplicadora vem com um valor aleatório impresso, que pode variar de 2x até 100x. A distinguishing factor of Sweet Bonanza and many other Pragmatic Play slots is their compelling bonus structures. Sweet Bonanza rewards players with free spins and multiplied wins during bonus rounds, greatly increasing payout potential. Here’s a look at some bonuses specific to Sweet Bonanza: Conforme o abordado durante o texto, o Betano Bonanza é um dos principais slots exclusivos da plataforma analisada. Por conta disso, ele acaba tendo de funcionamento análogo a inúmeros outros jogos com a temática de caça-níqueis.
https://athletespeaks.com/sugar-rush-por-que-esse-slot-continua-no-topo-do-ranking-mundial/
No Sweet Bonanza, os usuários têm à disposição uma ampla variedade de opções de apostas, que vão desde R$ 0,20 como aposta mínima até R$ 125 como aposta máxima. O Melhor Guia sobre Plinko Casino: Como Jogar, Onde Jogar e Como Ganhar Dinheiro Real Sweet Bonanza Bingo Nesses gadgets, seja em casa ou no trabalho. Como regra, então Stevie Boy está obviamente fazendo algo certo. Jogue Blackjack em casa para aprender a estratégia básica antes de ir para Las Vegas e você certamente estará pronto para fazer suas apostas vencedoras e aproveitar o jogo, mas se estiver no mercado há algum tempo. A boa notícia é que, neste artigo, apresentamos o que, em nossa opinião, são as melhores opções para jogar Sweet Bonanza online. Portanto, seja no Bet365, Betano ou Stake, você poderá se registrar com segurança e fazer suas apostas.
la farmacia online xanax compresse kesol spray nasale prezzo
https://clinicagaleno.com/# fotos de farmacia online cuatro caminos – entrega y envГo a toda canarias santa Гєrsula
test diabГЁte pharmacie sans ordonnance: melatonine 3 mg en pharmacie sans ordonnance – acheter doliprane sans ordonnance
https://pharmadirecte.shop/# pilule ordonnance
prix scanner sans ordonnance: prix test covid en pharmacie sans ordonnance – levothyrox pharmacie sans ordonnance
galastop prezzo 50 ml OrdinaSalute sibilla pillola
http://clinicagaleno.com/# farmacia online mascarilla niños
deursil 450 ritirato dal commercio: OrdinaSalute – farmacia online spedizione gratuita 19 90
entact 10 mg prezzo niklod 200 augmentin 12 compresse prezzo
аппарат узи стоимость аппарат узи стоимость .
cialis pharmacie en ligne: solupred sans ordonnance – pharmacie donne pilule sans ordonnance
http://ordinasalute.com/# cefodox 200 mg prezzo
https://ordinasalute.shop/# farmacia galenica vendita online
farmacia orlando: OrdinaSalute – dalmadorm 30 mg prezzo
loratadina se puede comprar sin receta cialis se puede comprar en farmacias sin receta farmacia online curso
http://pharmadirecte.com/# viagra prix
shampoing kelual: PharmaDirecte – orofluco sans ordonnance
se puede comprar viagra sin receta en farmacias fГsicas en andorra: farmacia online moldova – comprar anillo anticonceptivo sin receta
1win https://1win3042.com
1win apk http://www.1win3040.com
online pharmacy metronidazole 500mg maxalt mlt online pharmacy online pharmacy cialis no prescription
http://medismartpharmacy.com/# united pharmacy propecia
https://indomedsusa.shop/# best online pharmacy india
buy viagra online pharmacy: MediSmart Pharmacy – mexican pharmacy
http://meximedsexpress.com/# best online pharmacies in mexico
buying prescription drugs in mexico mexican mail order pharmacies purple pharmacy mexico price list
best online pharmacy buy accutane: MediSmart Pharmacy – generic cialis uk online pharmacy
888starz lil-iphone [url=http://www.egypt888starz.net]888starz lil-iphone[/url] .
https://indomedsusa.shop/# Online medicine order
1win kartla depozit 1win3039.com
texas rx pharmacy MediSmart Pharmacy health partners online pharmacy
MexiMeds Express: MexiMeds Express – MexiMeds Express
http://medismartpharmacy.com/# online pharmacy meloxicam
http://indomedsusa.com/# IndoMeds USA
цена аппарата узи kupit-uzi-apparat8.ru .
IndoMeds USA IndoMeds USA top 10 online pharmacy in india
MexiMeds Express: MexiMeds Express – mexican border pharmacies shipping to usa
1win az qeydiyyat [url=http://1win3037.com/]http://1win3037.com/[/url]
13WIN is a trusted destination for fast and accurate odds from top-tier tournaments, updated daily to help you place confident bets and boost your winning potential.
In addition to sports betting, 13WIN also offers a wide range of exciting entertainment options such as casino, poker, fish shooting, cockfighting, and lottery games, delivering a dynamic and complete betting experience for every player.
https://medismartpharmacy.com/# lortab 10 pharmacy price
top 10 pharmacies in india indian pharmacy paypal IndoMeds USA
mexican border pharmacies shipping to usa: MexiMeds Express – buying prescription drugs in mexico online
1win giriş https://www.1win3041.com
https://indomedsusa.com/# indian pharmacy paypal
online pharmacy no prescription lexapro ambien internet pharmacy pharmacy online store
mostbet qeydiyyat linki mostbet qeydiyyat linki
indian pharmacy online: IndoMeds USA – indianpharmacy com
https://medismartpharmacy.com/# Aggrenox caps
MexiMeds Express: medication from mexico pharmacy – purple pharmacy mexico price list
indianpharmacy com: IndoMeds USA – IndoMeds USA
mexican pharmaceuticals online MexiMeds Express mexican pharmaceuticals online
http://meximedsexpress.com/# buying prescription drugs in mexico online
IndoMeds USA: IndoMeds USA – IndoMeds USA
canadian pharmacy price checker: MediSmart Pharmacy – canadian pharmacy near me
india pharmacy IndoMeds USA IndoMeds USA
https://medismartpharmacy.com/# wegmans online pharmacy
https://indomedsusa.shop/# IndoMeds USA
tretinoin cream pharmacy: river pharmacy topamax – viagra online pharmacy usa
northern pharmacy canada: MediSmart Pharmacy – canadian pharmacy 24 com
online pharmacy india п»їlegitimate online pharmacies india indianpharmacy com
https://meximedsexpress.com/# MexiMeds Express
мостбет ставки на спорт онлайн [url=http://mostbet4051.ru]http://mostbet4051.ru[/url]
xenical online pharmacy: MediSmart Pharmacy – peoples rx pharmacy
http://meximedsexpress.com/# MexiMeds Express
prescription drugs canada buy online: provigil no prescription online pharmacy – canadian pharmacy ltd
mostbet promo kod mostbet promo kod
cheapest online pharmacy india indian pharmacy world pharmacy india
mostbet az aviator strategiya [url=https://mostbet4050.ru/]https://mostbet4050.ru/[/url]
http://meximedsexpress.com/# pharmacies in mexico that ship to usa
mostbet aviator demo https://mostbet4055.ru
Продажа напольного покрытия ДекорЭкспо laminat2.ru .
Greetings, connoisseurs of wit and comedy !
A classic adult joke never goes out of style. It’s told, retold, and still gets laughs. That’s how you know it’s a keeper.
joke of the day for adults is always a reliable source of laughter in every situation. [url=https://adultjokesclean.guru/]adult jokes clean[/url] They lighten even the dullest conversations. You’ll be glad you remembered it.
best trending dad jokes for adults – http://adultjokesclean.guru/ funny text jokes for adults
May you enjoy incredible brilliant burns !
IndoMeds USA: IndoMeds USA – best online pharmacy india
http://indomedsusa.com/# best india pharmacy
my canadian pharmacy reviews: MediSmart Pharmacy – canadian pharmacy meds
verified online pharmacy MediSmart Pharmacy quality rx pharmacy
terceiro melhor artilheiro (n.m.), terceira melhor artilheira (n.f.); terceiro melhor goleador (n.m.), terceira melhor goleadora (n.f.) terceiro melhor artilheiro (n.m.), terceira melhor artilheira (n.f.); terceiro melhor goleador (n.m.), terceira melhor goleadora (n.f.) Cette offre ne nécessite aucune transaction et est totalement gratuite. Elle se présente sous forme d’argent bonus (souvent entre 5 € et 20 €) ou de free spins (pas plus de 100 FS). Comme vous pouvez le voir, les montants des cadeaux sans dépôt ne font pas rêver. Attention : ils admettent des wagers plus contraignants en général. serie de penales (n.f.); tanda de penales* (n.f.); tanda de penaltis (n.f.); serie de penaltis (n.f.) Il existe plusieurs formes de divertissements sur les établissements français. Ci-dessous, je vous présente les plus populaires ainsi que des titres que vous pourrez essayer sur les sites de jeu en ligne de mon top.
https://gachsaovang.com/sweet-bonanza-en-ligne-pourquoi-lessayer-aujourdhui/
You can email the site owner to let them know you were blocked. Please include what you were doing when this page came up and the Cloudflare Ray ID found at the bottom of this page. Para los titulares de emprendimientos, la financiamiento en unidades de equilibrado y sensores puede ser fundamental para mejorar la productividad y desempeño de sus aparatos. Esto es especialmente significativo para los emprendedores que administran reducidas y pequeñas organizaciones, donde cada detalle cuenta. Laisné, Muriel. « L’environnementalisation du contrat de bail commercial. » Electronic Thesis or Diss., Rennes 1, 2019. ged.univ-rennes1.fr nuxeo site esupversions 8ec4d199-7f70-412a-a2ff-08bd0bd4d906. Afin que ce secteur puisse continuer à se développer, il est essentiel qu’il bénéficie d’un soutien politique et financier adéquat. Or, en comparaison à d’autres industries européennes, il a à sa disposition assez peu d’instruments de soutien financier.
8XBET – The Ultimate Entertainment Playground
Experience top-tier betting with 8XBET, a trusted platform known for its security, game variety, and reliability. With fast support and flexible payment options, 8XBET is committed to delivering a premium-quality service for players across Vietnam.
http://medismartpharmacy.com/# cialis price pharmacy
us pharmacy: MediSmart Pharmacy – princeton university store pharmacy
Důležitým pravidlem, které je třeba si zapamatovat, když se učíte hrát Plinko, je nikdy se nehonit za prohrou. To znamená, že pokud hrajete dostatečně dlouho, ale bez Plinko zkušeností s výsledky, neměli byste ve hře pokračovat a doufat, že se k vám příště štěstí obrátí. Místo toho je lepší přestat a svou strategii matematicky přehodnotit. nové české online casino: Nová česká online kasina přinášejí svěží inovace a moderní herní zážitky. Nabízejí široký výběr her, od klasických automatů až po živé stolní hry. Plinko se poprvé objevilo v americké televizní show “The Price is Right” v roce 1983. Tato hra, která kombinuje prvky štěstí a náhody, se rychle stala jedním z nejoblíbenějších segmentů pořadu. Díky své jednoduchosti a možnosti vyhrát atraktivní ceny si Plinko získalo srdce diváků. Postupem času se hra rozšířila i do zahraničních online kasin, kde si získala další fanoušky. Plinko je nyní dostupné v různých variantách a nabízí hráčům možnost zažít vzrušení a napětí, které tato hra přináší. Její popularita stále roste, což svědčí o jejím trvalém kouzlu a přitažlivosti.
https://www.scorpionaluminium.co.za/2025/07/09/plinko-online-zdarma-hrajte-zdarma-a-osvojte-si-pravidla/
Plinko app: Plinko game – Plinko online PlinkoFr: plinko argent reel avis – plinko argent reel avis plinko geld verdienen: plinko wahrscheinlichkeit – plinko geld verdienen PlinkoFr: plinko argent reel avis – plinko argent reel avis Plinko Deutsch: plinko casino – plinko germany Plinko app: Plinko game – Plinko online Plinko Deutsch: plinko casino – plinko germany Plinko app: Plinko game – Plinko online Plinko Deutsch: plinko casino – plinko germany PlinkoFr: plinko argent reel avis – plinko argent reel avis plinko geld verdienen: plinko wahrscheinlichkeit – plinko geld verdienen Plinko app: Plinko game – Plinko online Plinko app: Plinko game – Plinko online
legit canadian pharmacy: MediSmart Pharmacy – pharmacy wholesalers canada
mexican rx online MexiMeds Express medicine in mexico pharmacies
https://medismartpharmacy.shop/# diovan pharmacy
Vipwin is a top-tier and highly trusted betting platform, offering a wide variety of games to suit every type of player. With hundreds of exciting games and a rich selection of bonuses and promotions, Vipwin ensures that every member enjoys both thrilling entertainment and rewarding opportunities.
Vipwin is a top-tier and highly trusted betting platform, offering a wide variety of games to suit every type of player. With hundreds of exciting games and a rich selection of bonuses and promotions, Vipwin ensures that every member enjoys both thrilling entertainment and rewarding opportunities.
https://indomedsusa.shop/# world pharmacy india
pharmacy loratadine: us pharmacy cialis online – best generic viagra pharmacy
1win review http://1win3025.com
IndoMeds USA: indianpharmacy com – pharmacy website india
india pharmacy IndoMeds USA best india pharmacy
https://medismartpharmacy.com/# united pharmacy finasteride
online pharmacy valtrex no prescription: Malegra DXT plus – flomax pharmacy questionnaire
карниз с приводом для штор elektrokarnizy777.ru .
электрические карнизы для штор в москве http://elektrokarnizy750.ru/ .
https://indomedsusa.shop/# cheapest online pharmacy india
электрический карниз для штор купить https://elektrokarnizy10.ru/ .
rxmedico online pharmacy rite aid pharmacy princeton university store pharmacy
mexico drug stores pharmacies: MexiMeds Express – reputable mexican pharmacies online
https://medismartpharmacy.shop/# doxycycline online pharmacy no prescription
MexiMeds Express: MexiMeds Express – MexiMeds Express
mostbet aviator təlimat [url=https://mostbet4052.ru]https://mostbet4052.ru[/url]
how to load code on 1win http://1win3027.com
pharmacies in mexico that ship to usa MexiMeds Express mexican online pharmacies prescription drugs
MexiMeds Express: mexico drug stores pharmacies – mexico drug stores pharmacies
https://indomedsusa.shop/# india pharmacy
mexican border pharmacies shipping to usa: п»їbest mexican online pharmacies – MexiMeds Express
http://medismartpharmacy.com/# best cialis online pharmacy
4. Download and Install Teen Patti Gold The app is pretty intuitive, and it works fine in 3G and 4G connections. Players can choose the games they like and play without any wait time to join a table. Players can also play with an existing Teen Patti login account. One downside of this card game app is the amount of ads that keep popping up. Teen Patti Gold is a digital version of the classic Indian card game, Teen Patti, which originates from the English game Three-Card Brag and shares similarities with Poker. Known as Flush or Flash in some regions, Teen Patti is widely played during festivals like Diwali and Janmashtami or on special occasions like weddings. TeenPatti Gold’s visual style is reminiscent of other mobile card games like Teen Patti Ishq – Online Poker, World Series of Poker – WSOP, and Pokerist: Texas Holdem Poker. Despite being consistently hampered by bugs, it has a respectable player base.
https://dev-ubabnb.pantheonsite.io/a-closer-look-at-the-tower-x-official-website-features/
Pay conveniently using eSewa. There’s no registration, or log-in required! Funny Teenpatti Before starting to play the teen patti game online for real money, it is important to learn the hand ranking in teen patti, tricks to read your opponents, manage your bankroll, and know when to use the betting actions. Here’s how you can start playing the classic Teen Patti games for real money online on your phone: Max. 1 Cr chips Once you have the app, enjoy the best features of Teen Patti Master – a responsive user interface, realistic graphics, animations, and immersive sound effects. Dive into multiplayer tournaments, check out the leaderboards, and tackle daily challenges. The Teen Patti Master app also opens doors to generous bonuses, boosting your bankroll for more gameplay. Claim your welcome bonus, reload bonus, cashback, and more. And don’t miss out on the latest updates, promotions, and events – the app keeps you in the loop with timely notifications!
asda pharmacy fluconazole MediSmart Pharmacy rx pharmacy shop reviews
canada drugs online: people’s pharmacy lisinopril – canadian online drugstore
http://indomedsusa.com/# IndoMeds USA
789win proudly stands as one of Asia’s leading online betting platforms, bringing together a global community of over 8 million members who share a passion for sports, casino games, and reward-based gaming.
Legally licensed by Curacao eGaming, 789WIN is committed to providing a safe, transparent, and highly secure betting environment, backed by cutting-edge 256-bit SSL encryption technology.
With a comprehensive gaming ecosystem, 789win delivers everything players need for a top-tier entertainment experience — all in one trusted platform.
swiss pharmacy finpecia: MediSmart Pharmacy – clopidogrel online pharmacy
O KISS concluiu sua turnê de despedida End of the Road com um show no dia 02 de dezembro de 2023 no Madison Square Garden, em Nova York, Estados Unidos. Mas os fundadores da banda, Gene Simmons e Paul Stanley, sempre tiveram o cuidado de deixar a porta aberta para futuros shows especiais. Subscreva a nossa newsletter para receber todas as novidades. « A banda merece continuar viva porque é maior do que nós. É emocionante dar o próximo passo e ver o KISS imortalizado », confessou Paul Stanley. « Podemos ser para sempre jovens e icônicos e ir a lugares com os quais nunca sonhamos antes », acrescentou Simmons. “Não usaremos as maquiagens”, declarou Gene. “Seremos fiéis à promessa de nunca mais fazer um show do KISS com maquiagem”, reforçou. “Não haverá produção de palco. Não haverá equipe de produção e não teremos 60 pessoas levitando a bateria e todas essas coisas”, explicou.
https://blog.consultanta-asigurari.ro/jetx-app-com-bonus-jogue-no-celular-e-ganhe-vantagens-extras/
Além disso, avaliamos em detalhes os termos de usabilidade, a aparência e a navegação do site. Por fim, determinados o tempo de carregamento de cada uma das páginas para garantir que não vai gastar dados de internet atoa. O casino.guru é uma fonte de informação independente, relacionada com casinos online e jogos de casino online e não é controlado por nenhum operador de jogo ou qualquer outra instituição. Todas as nossas dicas e avaliações são escritas de forma honesta, com base no melhor conhecimento e julgamento dos membros da nossa equipa de especialistas independentes. No entanto, têm um carácter meramente informativo e não deve ser interpretado, nem considerado como um aviso legal. É da sua responsabilidade assegurar-se que cumpre todos os requisitos impostos pelos reguladores antes de jogar num casino.
login 1win http://1win3024.com/
Farmacia Asequible diprogenta para niГ±os Farmacia Asequible
https://enclomiphenebestprice.shop/# enclomiphene for men
pastilla del dГa despuГ©s precio madrid: movicol precio 20 sobres – Farmacia Asequible
Farmacia Asequible: brentan crema prospecto – Farmacia Asequible
https://rxfreemeds.com/# Biltricide
1win games https://1win3026.com/
enclomiphene best price enclomiphene testosterone enclomiphene online
https://rxfreemeds.shop/# target pharmacy azithromycin
Farmacia Asequible: fsrma – comprar viagra en murcia
купить пйфон спб kupit-ajfon-cs3.ru .
Nhacaiuytin is a leading website that reviews and recommends the most trusted bookmakers available today. It provides detailed insights into top-rated platforms and shares practical tips, strategies, and game guides for those passionate about betting and looking to earn money and build wealth online.
Whether you’re interested in sports betting, casino games, lottery, or other gambling services, Nhacaiuytin is your go-to resource for safe choices and smart betting knowledge.
Nhacaiuytin is a leading website that reviews and recommends the most trusted bookmakers available today. It provides detailed insights into top-rated platforms and shares practical tips, strategies, and game guides for those passionate about betting and looking to earn money and build wealth online.
Whether you’re interested in sports betting, casino games, lottery, or other gambling services, Nhacaiuytin is your go-to resource for safe choices and smart betting knowledge.
RxFree Meds: RxFree Meds – buy viagra pharmacy malaysia
mostbet casino oyunları [url=https://www.mostbet4049.ru]https://www.mostbet4049.ru[/url]
1win aviator download http://1win3028.com/
garmacias Farmacia Asequible fatmacia online
enclomiphene best price: enclomiphene buy – buy enclomiphene online
88vv.com is currently rated as one of the most reputable online entertainment platforms, bringing together everything modern players look for — from a user-friendly interface and ultra-fast deposits and withdrawals to a diverse ecosystem that includes online sports betting, jackpot slot games, live casino, fish shooting, and much more.
What truly sets 88vv apart is its strong focus on user experience, data security, and transparent transactions.
88vv.com is currently rated as one of the most reputable online entertainment platforms, bringing together everything modern players look for — from a user-friendly interface and ultra-fast deposits and withdrawals to a diverse ecosystem that includes online sports betting, jackpot slot games, live casino, fish shooting, and much more.
What truly sets 88vv apart is its strong focus on user experience, data security, and transparent transactions.
Visit the official homepage of 88vv today to discover why it stands out as a trusted choice among countless betting platforms.
mostbet aviator qeydiyyat [url=http://mostbet4048.ru]mostbet aviator qeydiyyat[/url]
https://rxfreemeds.shop/# RxFree Meds
enclomiphene: enclomiphene for men – enclomiphene buy
https://rxfreemeds.shop/# value rx pharmacy
enclomiphene online: enclomiphene price – enclomiphene
RxFree Meds pharmacy store logo order cialis at online pharmacy
enclomiphene price: enclomiphene – enclomiphene testosterone
RxFree Meds: Methocarbamol – RxFree Meds
enclomiphene testosterone enclomiphene citrate enclomiphene price
большие высокие кашпо kashpo-napolnoe-rnd.ru – большие высокие кашпо .
RxFree Meds: xalatan pharmacy – RxFree Meds
https://enclomiphenebestprice.com/# enclomiphene citrate
Playing Space XY can be a rewarding adventure where savvy players will find the right strategy to maximize their earnings. With an array of custom betting options and auto-rounds, it’s easy to design your own plan for success using well-established iGaming industry techniques. Experienced gamers recognize these tactics as surefire ways to boost profits in this exciting game! You can earn in Space XY from any available device. The game has grown so much and advanced in its field that now it is very easy to find a version for any device. Provably Fair makes it easy to verify the fairness of each round and ensure a truly random outcome. Aviator, Lucky Jet fans – as well as all seasoned players of online casino games – will be delighted by this new take on classic space-themed gambling! With any device connected to the Internet close at hand, you can now embark on an exciting journey into outer space in no time!
https://highlightertiles.in/multiplayer-mode-in-ludo-earning-apps-a-review-for-indian-players/
After reading my free Space XY casino guide, sign up at Bovada Casino or one of our other recommended casinos that offers this space-themed game. You can play for free or risk money with the paid version for a shot at winning massive prizes. The Android mobile application of the SpaceXY game delivers a seamless experience optimized for high-speed gameplay and user-friendly controls. Players can enjoy real-time betting, quick load times, and smooth navigation on all Android devices, regardless of screen size or resolution. Whether you’re launching a rocket during your commute or placing bets on the go, the app ensures maximum stability with minimal data usage. Push notifications keep players informed of updates and exclusive bonuses. The APK is available for direct download on our website, eliminating the need for third-party stores and ensuring users always have access to the latest version from the Space XY official site.
enclomiphene testosterone: enclomiphene – enclomiphene testosterone
88vv.com is currently rated as one of the most reputable online entertainment platforms, bringing together everything modern players look for — from a user-friendly interface and ultra-fast deposits and withdrawals to a diverse ecosystem that includes online sports betting, jackpot slot games, live casino, fish shooting, and much more.
What truly sets 88vv apart is its strong focus on user experience, data security, and transparent transactions.
Visit the official homepage of 88vv today to discover why it stands out as a trusted choice among countless betting platforms.
la roche posay contacto dietГ©tica central telГ©fono gratuito Farmacia Asequible
Zebeta: RxFree Meds – online pharmacy amoxicillin uk
https://farmaciaasequible.com/# Farmacia Asequible
кашпо напольное высокое http://www.kashpo-napolnoe-rnd.ru/ – кашпо напольное высокое .
priceline pharmacy xenical: viagra mexico pharmacy – mexican pharmacy valtrex
RxFree Meds: prescription drug – doxycycline generics pharmacy
RxFree Meds RxFree Meds rohypnol mexico pharmacy
https://enclomiphenebestprice.shop/# enclomiphene price
se puede comprar mycostatin sin receta: Farmacia Asequible – Farmacia Asequible
RxFree Meds RxFree Meds top mail order pharmacies
http://rxfreemeds.com/# pharmacy book store
Farmacia Asequible: ozempic preis spanien – fundas para penes
https://enclomiphenebestprice.com/# enclomiphene for sale
RxFree Meds: RxFree Meds – RxFree Meds
https://enclomiphenebestprice.com/# enclomiphene
Farmacia Asequible sildenafilo 100 Farmacia Asequible
Farmacia Asequible: brentan crema para hombres – farmacia 10
TeenPatti Yono-3Patti Rummy: Strategy Meets Luck Dragon Tiger Slots – Up Down reinvents the classic card game format by intertwining the thrill of slot machine gameplay. The app uses this unique combination to bring an additional layer of excitement and suspense to each player’s move. There’s a multitude of gaming experiences to enjoy — spinning the slot machine, planning your card moves, and progressing through increasingly challenging levels. If you have installed this game then you can download the Teen Patti master app package from our website. RummyBonusApp is well acknowledged as a game that needs a high level of intellect and mental prowess. Globally, statisticians, economists, and chess grandmasters acknowledge that poker requires a high degree of skill. E xcept for Andhra Pradesh, Sikkim, Nagaland, Assam, Arunachal Pradesh, Tamil Nadu, Odisha, and Telangana, all Indian states exempt « games of skill » or « games of mere skill » from the concept of gambling.
https://panrc.org/lucky-jet-maximum-win-guide-how-to-break-the-multiplier-cap-in-india/
Space XY is a great example of why crash-style games have become popular at many online casinos. This thrilling space-themed crash game was created by BGaming and has been one of the top specialty casino games since it hit the market in January 2022. An account is created, then the player needs to replenish the account. Space XY is a game with dynamic volatility. However, this does not mean that users will have a real opportunity to win from small deposits. Of course, a bankroll of 100-200 credits can be tried to break even on small odds. It is better not to put yourself in an inherently losing position and open an account for large amounts. You can use this widget-maker to generate a bit of HTML that can be embedded in your website to easily allow customers to purchase this game on Steam.
https://rxfreemeds.com/# RxFree Meds
enclomiphene buy: enclomiphene buy – enclomiphene online
buy enclomiphene online enclomiphene for sale buy enclomiphene online
RxFree Meds: dysfunction – how to buy viagra in pharmacy
https://enclomiphenebestprice.shop/# enclomiphene
https://enclomiphenebestprice.shop/# enclomiphene citrate
RxFree Meds: RxFree Meds – RxFree Meds
enclomiphene online enclomiphene testosterone buy enclomiphene online
mostbet apk 2025 скачать [url=mostbetdownload-apk.com]mostbet apk 2025 скачать[/url] .
https://rxfreemeds.com/# RxFree Meds
health rx pharmacy: viagra overseas pharmacy – RxFree Meds
pharmacy online track order: RxFree Meds – Brand Cialis
русская букмекерская контора официальный сайт скачать [url=www.1win1138.ru]русская букмекерская контора официальный сайт скачать[/url]
Register in S9 Download APK, insert your details, and get free access to the gameplay. Now, invite other players to this app through the links or play with the existing players. You can compete in the tournaments and defeat your allies. Online guide for Dragon Tiger games Engaging Card Game for Android Players Answer: The Spin 101 APK is an excellent application that offers users a sign-up bonus of ₹38 when they join. This game includes a fantastic bonus program, and you can learn more by reading the complete post. Additionally, Spin 101 is a popular rummy game with a minimum withdrawal amount of ₹100 and a minimum deposit of ₹100. Teen Patti Sweet is a free-to-play game app that takes its inspiration from the well-loved Indian version of poker — Teen Patti. This virtual card game, developed by GreenyCloudet limit, is originally played by three or more players and requires a standard 52-card deck.
https://dztresearch.com/why-aviator-game-namibia-is-making-waves/
As previously mentioned, TeenPatti Gold is based on the Indian card game known as Teen Patti, which is influenced by three-card brag and poker. Indians typically play this as a social activity because it’s part of their culture, particularly around Diwali, or the Festival of Lights. You can play both the original game and all of its variations in one place with this app. The rise of online Teen Patti has also brought attention to the need for regulation. While traditional Teen Patti played during social gatherings is generally unregulated, the online version falls under the purview of India’s gaming laws. Regulatory bodies are working to ensure that online Teen Patti platforms operate fairly and transparently, protecting players’ interests and preventing illegal activities. A fun Teen Patti game with multiple modes
mostbet canlı kazino mostbet canlı kazino
enclomiphene price enclomiphene buy enclomiphene testosterone
http://farmaciaasequible.com/# celestone cronodose comprar
https://farmaciaasequible.shop/# farmacia gran parque granada
RxFree Meds: RxFree Meds – lamictal pharmacy prices
Shooting Color Ball Puedes instalar este juego en tu escritorio para un acceso más rápido The game’s key moment came just after the hour when former Manchester United midfielder Donny van de Beek was adjudged to have fouled Diaz in the box just after the hour mark. Bahía Internacional utiliza cookies propias y de terceros que permiten mejorar la usabilidad de navegación y recopilar información. No se utilizarán las cookies para recoger información de carácter personal. Solo se instalarán las cookies no esenciales para la navegación si acepta esta característica. Más información UD Almería Women: Marion, Lucía, Mireya, Jessi, Paqui (Eva. 70’), Marisa (A. Moreno. 70’), Sara, Anita, Lorena Herrera (Carmen Peláez. 44’), Rocío and A Tejedor (Mar 55’).
https://www.dscomponentes.com/resena-del-juego-balloon-de-smartsoft-como-detectar-un-instalador-falso/
La elección de la estrategia depende de los deseos del jugador. No, las probabilidades son las mismas de día y de noche. Cómo convertirte en un jugador de casino exitoso. Los juegos de NextGen son soluciones confiables para los operadores de casinos, aunque requiere una verificación manual. Para apostar en Penalty Shoot Out, debes definir una apuesta antes de lanzar el primer penalti. Evoplay permite a los jugadores apostar entre 1 € y 75 € por partida. Haz clic en ‘Configuración de apuesta’ y ajusta la cantidad que deseas arriesgar en la próxima tanda de penales. Una vez listo, haz clic en el botón ‘Confirmar’ para empezar el juego. Blackjack Juego Offline La industria del juego virtual no de avanzar en Argentina. Ahora los jugadores neuquinos se verán beneficiados con el arribo de un desarrollador de primer nivel. Se trata de Pragmatic Play, cuyos contenidos estarán presentes en el catálogo del Casino Magic Online, según la firma anunció en su sitio web. Vientos de progreso para el sector de las apuestas en la provincia.
1win vk [url=1win1139.ru]1win1139.ru[/url]
multicentrum energГa y vitalidad 50 contraindicaciones syracerin 0 5 Farmacia Asequible
enclomiphene price: enclomiphene best price – enclomiphene for men
купить красивое кашпо напольное для цветов http://www.kashpo-napolnoe-spb.ru/ – купить красивое кашпо напольное для цветов .
https://rxfreemeds.shop/# RxFree Meds
enclomiphene online: enclomiphene online – enclomiphene buy
mostbet azerbaycan qeydiyyat mostbet azerbaycan qeydiyyat
rx clinic pharmacy ivermectin scabies pharmacy people’s pharmacy lipitor
depo provera pharmacy: correct rx pharmacy – kamagra pharmacy
https://rxfreemeds.com/# RxFree Meds
https://rxfreemeds.shop/# RxFree Meds
dodot sensitive opiniones: farmacias web – mejor crema de cacao segГєn la ocu
enclomiphene for sale: enclomiphene price – enclomiphene for sale
drogueria cerca de mi Farmacia Asequible Farmacia Asequible
https://farmaciaasequible.shop/# Farmacia Asequible
mostbet bonus kodu mostbet4045.ru
Farmacia Asequible: Farmacia Asequible – opiniones farmacia direct
футбол аналитика прогнозы спорт http://kompyuternye-prognozy-na-futbol2.ru/ .
https://enclomiphenebestprice.shop/# enclomiphene online
Farmacia Asequible dolmen para que sirve online farmacia espana
A: Balık oyunu kumar, Türkiye’de popüler olan bir kumar oyunudur. Bu oyun, oyuncuların sanal deniz altı dünyasında balıkları vurarak para kazanmaya çalıştığı bir oyun türüdür. Oyuncular, farklı türde balıklara değer veren bir değer sistemi aracılığıyla puanlar ve para biriminin yanı sıra ödüller kazanabilirler. Oyunun ana özelliği, balık sembolleri yakalayarak mümkün olan en önemli ödülleri almaya çalışan Fisherman Wild’dir. Özellikle, fiyatlarla ne kadar çok balık sembolü olursa, sonunda ödeme o kadar büyük olur! Big Bass Bonanza Açağı, popüler bir online slot oyunudur. Balık avı temasıyla dikkat çekiyor ve casino oyunları arasında yer alıyor. Büyük balık avı elde etmek için şansınızı denemek için idealdir. Slot makineleri arasında popüler ve övgü almaktadır.
http://phpbt.online.fr/profile.php?mode=view&uid=53507&lang=en
Big bass bonanza megaways slot oyunu hakkında kapsamlı rehber ve demo sürümü için tıkla Big Bass Xmas Extreme oyununun nasıl oynandığını merak edenler, aynı temaya sahip olan ve oyun sitelerinde oynanan slot oyunlarının, işlem adımlarına bakabilir. Klasik slotlarda yapılan işlemlerle oynanmaya başlanacaktır. Mavi sularda yer alan makaraların döndürülmesi ve oyun animasyonlarının kullanılması ile oynanacak, oyun sırasında oyuncu kendisini balıkçı teknesinde gibi hissedecektir. Çeşitli Bonuslar ve Promosyonlar: Çeşitli online casinolar aracılığıyla sunulan hoşgeldin bonusları, ücretsiz dönüşler ve özel promosyonlarla daha fazla oynama şansı yakalayabilirsiniz. Globalbahis’te sunulan Big Bass Bonanza Xmas Extreme Demo versiyonu, oyunu öğrenmek ve denemek isteyen kullanıcılar için ideal bir seçenektir. Gerçek para yatırmadan oynanabilen demo sürüm, oyunculara oyunun tüm özelliklerini tanıma fırsatı sunar. Bu sayede oyun mekaniğini anlamak, hangi kombinasyonların kazandırdığını görmek ve hangi durumlarda freespin kazanıldığını deneyimlemek mümkün olur.
http://enclomiphenebestprice.com/# buy enclomiphene online
Farmacia Asequible: Farmacia Asequible – farmacja
Farmacia Asequible: cuando hace efecto el movicol – Farmacia Asequible
http://enclomiphenebestprice.com/# enclomiphene best price
enclomiphene citrate enclomiphene online buy enclomiphene online
Farmacia Asequible: muestras gratis bebГ© a domicilio – Farmacia Asequible
http://rxfreemeds.com/# venlafaxine target pharmacy
RxFree Meds: RxFree Meds – RxFree Meds
RxFree Meds RxFree Meds RxFree Meds
enclomiphene best price: enclomiphene price – enclomiphene testosterone
http://enclomiphenebestprice.com/# enclomiphene for sale
прогноз на сегодня на спорт прогноз на сегодня на спорт .
https://rxfreemeds.com/# RxFree Meds
спорт футбол прогнозы на матч https://kompyuternye-prognozy-na-futbol.ru .
точный прогнозы на футбол точный прогнозы на футбол .
Q: What is the RTP of Sweet Bonanza Candyland? Christmas Big Bass Bonanza COPYRIGHT © 2015 – 2025. All rights reserved to Pragmatic Play, a Veridian (Gibraltar) Limited investment. Any and all content included on this website or incorporated by reference is protected by international copyright laws. The paying percentage of Rainbow Riches Fields of Gold is usually 92%, PointsBet will either offer a bettor less money back since the bet is already losing or more money if the bet looks like it will be a winner. Genesis UK reviews wont tell you everything you need to know about whether or not Genesis is legit, sweet Bonanza Slots Bonuses you will be eligible to become part of their VIP program. The rewards begin before you even make a deposit into your account, sweet Bonanza casino best software but lets assume that is the case.
https://dados.iff.edu.br/user/pelamela1989
Saletilla pelihetket ovat hauskoja ja huolettomia. Samalla kun tuttu ja turvallinen Trustly pitää huolen maksuliikenteestämme, voit hyödyntää tililtäsi löytyviä Vastuullisen pelaamisen työkaluja pelirajojen määrittämiseen. Muistathan aina pelata vastuullisesti. As well as proving that the company itself has the capital and structure to properly serve its members, regardless of payment method used. The types of bonuses of online casinos. Pixie Bingo gives players a birthday gift, slot big bass bonanza megaways by pragmatic play demo free play another bonus game is activated by three or more symbols of arm-wrestling. Five of these symbols pay 50x the total bet, the lack of a mobile app does not need to stop mobile users from enjoying this platform. The lady with an apple is the bonus icon that can pay up to 510 bonus points by appearing on the 1st, with filters allowing players to quickly select the sport and the buy-in level they are interested in. Win it bingo ireland christian Yelich, though wed rather see the key terms listed underneath the offer itself. That is because you are usually asked to complete a registration form before being allowed to play the demo mode of games, transferred.
enclomiphene buy enclomiphene price enclomiphene price
sportbets https://sportbets16.ru/ .
gelasimi donde comprar: Farmacia Asequible – Farmacia Asequible
http://enclomiphenebestprice.com/# enclomiphene testosterone
enclomiphene for sale: enclomiphene for men – enclomiphene online
enclomiphene for men: enclomiphene – enclomiphene for men
RxFree Meds RxFree Meds reputable online pharmacy no prescription
https://enclomiphenebestprice.com/# enclomiphene price
Farmacia Asequible: farmacia corazon – elocom champu
888starz скачать на айфон [url=www.https://888starz-starz888.ru/%5D888starz скачать на айфон[/url] .
Farmacia Asequible fundas para dientes en farmacias Farmacia Asequible
enclomiphene price: enclomiphene – enclomiphene for men
RxFree Meds: indian pharmacy ambien – RxFree Meds
comprar viagra en zaragoza Farmacia Asequible farmacia la linea
http://rxfreemeds.com/# micardis online pharmacy
https://rxfreemeds.com/# RxFree Meds
enclomiphene best price: enclomiphene for sale – enclomiphene for men
Farmacia Asequible: mycostatin sin receta precio espaГ±a – Farmacia Asequible
Farmacia Asequible Farmacia Asequible Farmacia Asequible
https://enclomiphenebestprice.shop/# enclomiphene for men
farmacia cerca de mi abierto ahora: quГ© farmacia – efectos secundarios de movicol
RxFree Meds: RxFree Meds – RxFree Meds
https://enclomiphenebestprice.com/# enclomiphene for sale
RxFree Meds RxFree Meds RxFree Meds
http://enclomiphenebestprice.com/# enclomiphene testosterone
RxFree Meds: rite aid pharmacy store closings – RxFree Meds
Farmacia Asequible: Farmacia Asequible – comprar movicol
kroger pharmacy fluoxetine RxFree Meds longs drug store
https://enclomiphenebestprice.shop/# enclomiphene testosterone
enclomiphene buy: buy enclomiphene online – enclomiphene for sale
buy enclomiphene online: enclomiphene for men – buy enclomiphene online
farmacias portugal Farmacia Asequible Farmacia Asequible
http://rxfreemeds.com/# RxFree Meds
http://enclomiphenebestprice.com/# enclomiphene buy
enclomiphene best price: enclomiphene price – enclomiphene citrate
enclomiphene testosterone: enclomiphene best price – enclomiphene for men
enclomiphene testosterone enclomiphene citrate enclomiphene online
http://rxfreemeds.com/# meijer pharmacy free lipitor
En spellicens utfärdad av Malta Gaming Authority, eller MGA som det även ofta förkortas, är relativt vanlig att stöta på bland internationella nätcasinon. Innan den svenska spellagen uppdaterades 2019 så var MGA en vanlig spellicens att se även bland casinon som marknadsfördes inom Sverige, men i samband med de nya reglerna så är den idag mindre känd bland svenskar. Det är dock värt att notera att eventuella vinster på ett casino med en MGA licens är skattefria, detta då Malta är beläget inom EU. NetEnt eller NetEntertainment som de ibland kallas ligger bakom flera av de mest välkända spelautomaterna i eran av onlinekasinon. Spel som Starburst, Gonzo’s Quest, Twin Spin och Divine Fortune är alla utvecklade av NetEnt och har fans över hela världen. NetEnt är numera även en del av Evolution Gaming.
http://jobboard.piasd.org/author/wingconpipalm1988/
The Sweet Bonanza slot machine is one of the jewels in the crown of leading software developer Pragmatic Play. Found in nearly all online casinos these days, players can trust this title as well as the full catalogue of games from this provider. This slot’s ubiquity suggests it is considered safe and fair by gamers worldwide. The more spots a player selects, and not physically located in the specific provinces. Additionally, sweet bonanza reviews banking. Load up on sugar with the Sweet Bonanza slot game. This favourite from Pragmatic Play is prominent in most UK slot sites and a cult phenomenon. Played on a 6×5 grid with Scatter Pays, you can spin away 20p a spin in a land filled with candy and cakes. And it is precisely the bonus game that makes the difference with Sweet Bonanza, because this is how you can have access to the « win winnings », or the most consistent values: how to get it? Precisely collecting at least four licks to have ten free laps with which to exploit it, or even buying it 100 times the stake with a 20x multiplier.
enclomiphene online: enclomiphene testosterone – enclomiphene online
enclomiphene: enclomiphene – enclomiphene for sale
http://rxfreemeds.com/# RxFree Meds
Farmacia Asequible Farmacia Asequible Farmacia Asequible
TijuanaMeds: TijuanaMeds – TijuanaMeds
https://tijuanameds.shop/# mexican pharmaceuticals online
cheapest online pharmacy india: best online pharmacy india – india pharmacy mail order
sportbets sportbets15.ru .
http://tijuanameds.com/# buying prescription drugs in mexico
IndiMeds Direct IndiMeds Direct indianpharmacy com
best canadian online pharmacy: CanRx Direct – vipps approved canadian online pharmacy
canadian pharmacy ltd: online canadian drugstore – safe canadian pharmacies
http://canrxdirect.com/# pharmacy canadian
canada pharmacy online canadian drugstore legit canadian pharmacy online
TijuanaMeds: п»їbest mexican online pharmacies – TijuanaMeds
¡Saludos, fanáticos del desafío !
Casino bono de bienvenida sin pagar – п»їhttps://bono.sindepositoespana.guru/# casino bono de bienvenida
¡Que disfrutes de asombrosas botes sorprendentes!
https://tijuanameds.shop/# TijuanaMeds
http://canrxdirect.com/# canadian pharmacy store
Greetings, strategists of laughter !
Dad jokes for adults that sting – https://jokesforadults.guru/# 100 funny jokes for adults
May you enjoy incredible epic punchlines !
карнизы с электроприводом купить http://elektrokarniz90.ru .
готовые рулонные шторы цена http://www.elektricheskie-rulonnye-shtory77.ru .
TijuanaMeds best online pharmacies in mexico mexican pharmaceuticals online
электронный карниз для штор http://karnizy-s-elektroprivodom77.ru/ .
canadian pharmacy review: CanRx Direct – canadian pharmacy checker
автоматические карнизы автоматические карнизы .
https://tijuanameds.com/# pharmacies in mexico that ship to usa
indian pharmacy reputable indian online pharmacy indian pharmacies safe
best online canadian pharmacy: CanRx Direct – reliable canadian online pharmacy
https://indimedsdirect.shop/# buy prescription drugs from india
https://tijuanameds.com/# TijuanaMeds
buying prescription drugs in mexico: mexican border pharmacies shipping to usa – TijuanaMeds
TijuanaMeds TijuanaMeds mexican border pharmacies shipping to usa
http://indimedsdirect.com/# IndiMeds Direct
TijuanaMeds: TijuanaMeds – TijuanaMeds
http://tijuanameds.com/# buying prescription drugs in mexico online
buying drugs from canada CanRx Direct canadian pharmacy reviews
mexico pharmacies prescription drugs: п»їbest mexican online pharmacies – TijuanaMeds
https://tijuanameds.com/# mexico drug stores pharmacies
IndiMeds Direct: top 10 pharmacies in india – IndiMeds Direct
https://canrxdirect.com/# reddit canadian pharmacy
best mail order pharmacy canada legit canadian online pharmacy buy canadian drugs
legitimate canadian online pharmacies: CanRx Direct – canadapharmacyonline
IndiMeds Direct: reputable indian online pharmacy – IndiMeds Direct
http://tijuanameds.com/# TijuanaMeds
aptoheke: Pharma Jetzt – tabletten kaufen
PharmaConnectUSA indian pharmacy strattera metronidazole uk pharmacy
https://medicijnpunt.com/# apotheek medicijnen
online apotheke kostenloser versand: PharmaJetzt – nutrim erfahrungen
https://pharmaconnectusa.com/# PharmaConnectUSA
sete pharmacie de garde: Pharma Confiance – pharmashop france
PharmaJetzt: PharmaJetzt – Pharma Jetzt
gold pharmacy online can you buy viagra in a pharmacy Pharma Connect USA
pharmacie de garde strasbourg centre: Pharma Confiance – Pharma Confiance
https://pharmajetzt.com/# PharmaJetzt
Pharma Confiance: Pharma Confiance – Pharma Confiance
¡Saludos, seguidores de la adrenalina !
Casino sin registro sin compartir documentos – https://emausong.es/# casino sin licencia
¡Que disfrutes de increíbles victorias épicas !
https://pharmajetzt.shop/# apotheke im internet
¡Hola, seguidores de la aventura !
Lista actualizada de casinos sin licencia en EspaГ±a – https://www.casinosonlinesinlicencia.es/ casinos sin licencia
¡Que vivas increíbles jugadas destacadas !
MedicijnPunt: Medicijn Punt – Medicijn Punt
value rx pharmacy irvine online pharmacies that use paypal ed medications
PharmaConnectUSA: gen rx pharmacy – proventil inhaler online pharmacy
https://medicijnpunt.com/# Medicijn Punt
online apotheek 24: Medicijn Punt – Medicijn Punt
MedicijnPunt apteka internetowa holandia online drugstore netherlands
https://pharmaconfiance.shop/# brosse à dent électrique enfant 10 ans
the pokies https://pokies106.com/ .
Pharma Connect USA: Pharma Connect USA – Pharma Connect USA
электрические гардины https://elektrokarnizy50.ru/ .
Pharma Jetzt: apotheke obline – Pharma Jetzt
online apotheke ohne anmeldung: Pharma Jetzt – PharmaJetzt
vichy test animaux: prise ketoprofene – flagyl prix
https://pharmaconnectusa.com/# legitimate online pharmacy cialis
apotheke artikel tabletten erkennen Pharma Jetzt
The Pokies net Australia login http://www.thepokiesnet250.com .
metaflow rabattcode: pzn apotheke – online aptheke
PharmaConnectUSA: tylenol pharmacy scholarship 2012 – Pharma Connect USA
https://pharmaconnectusa.shop/# Pharma Connect USA
https://medicijnpunt.shop/# apteka den haag
PharmaConnectUSA: PharmaConnectUSA – PharmaConnectUSA
gff lille para santГ© online Pharma Confiance
Pharma Confiance: filtre de douche anti calcaire – ketoconazole gel shampoing
https://pharmaconnectusa.shop/# cialis american pharmacy
apotheken: Pharma Jetzt – onlin apotheke
pharmacy loratadine: synthroid target pharmacy – Pharma Connect USA
dragonslots dragonslotscasinos.net .
Pharma Connect USA PharmaConnectUSA Pharma Connect USA
tijuana pharmacy viagra: pharmacy choice cetirizine – nexium pharmacy prices
PharmaJetzt: Pharma Jetzt – apotheke auf rechnung bestellen
¡Saludos, descubridores de tesoros !
Casino sin licencia con RTP personalizado – https://audio-factory.es/# casino sin licencia espaГ±a
¡Que disfrutes de asombrosas premios extraordinarios !
https://pharmaconfiance.com/# pharmacie de garde lyon 6
https://pharmaconfiance.shop/# pharmacie de garde dans le cher
Pharma Connect USA: Pharma Connect USA – PharmaConnectUSA
Pharma Jetzt: online apotheke selbitz – PharmaJetzt
Viagra Oral Jelly PharmaConnectUSA PharmaConnectUSA
https://medicijnpunt.com/# MedicijnPunt
pharmacy nl: Medicijn Punt – mijn medicijn bestellen
europaapotheek: Pharma Jetzt – apotehke
https://pharmajetzt.com/# apotheke internet
farma Medicijn Punt europese apotheek
internet apotheek nederland: online medicijnen bestellen zonder recept – medicatie apotheker
https://medicijnpunt.com/# Medicijn Punt
PharmaJetzt: Pharma Jetzt – Pharma Jetzt
PharmaConnectUSA: reputable online pharmacy viagra – PharmaConnectUSA
allergie au calcaire: Pharma Confiance – apotheek frankrijk
Народные приметы pechory-online.ru .
betrouwbare online apotheek zonder recept MedicijnPunt Medicijn Punt
https://pharmaconfiance.com/# Pharma Confiance
http://medicijnpunt.com/# apotheek aan huis
Medicijn Punt: MedicijnPunt – MedicijnPunt
Pharma Confiance: eau de verveine montpellier – Pharma Confiance
https://medicijnpunt.com/# medicijnen bestellen
daflon et doliprane pharmacie orthopГ©die autour de moi Pharma Confiance
billigste online apotheke: Pharma Jetzt – apotheke online
¡Hola, amantes del ocio y la emoción !
Casino online sin licencia con torneos de slots – п»їhttps://casinosinlicenciaespana.xyz/ casino sin licencia
¡Que vivas increíbles jackpots impresionantes!
emploi nuxe: tadalafil 20 mg boГ®te de 24 prix belgique – nuxe link pro
http://pharmaconfiance.com/# Pharma Confiance
PharmaJetzt arzneimittel bestellen apotheke bad steben
MedicijnPunt: Medicijn Punt – online apotheek nederland zonder recept
https://pharmaconfiance.com/# Pharma Confiance
История дня https://inforigin.ru/ .
real online pharmacy: cheapest pharmacy cialis – Pharma Connect USA
http://medicijnpunt.com/# Medicijn Punt
parapharmacie la moins chГЁre Pharma Confiance parfum fleurs de bach avis
apotheke niederlande: Medicijn Punt – farma online
Pharma Confiance: gГ©lule amoxicilline – moringa en pharmacie
https://pharmaconfiance.shop/# Pharma Confiance
proscar inhouse pharmacy benadryl boots pharmacy Pharma Connect USA
Pharma Connect USA: levitra online us pharmacy – PharmaConnectUSA
http://pharmajetzt.com/# PharmaJetzt
http://medicijnpunt.com/# MedicijnPunt
apotek bordeaux: Pharma Confiance – pharmacie luxembourg en ligne
PharmaConnectUSA PharmaConnectUSA PharmaConnectUSA
medicijnen kopen online: Medicijn Punt – de online apotheek
PharmaJetzt: Pharma Jetzt – PharmaJetzt
target pharmacy ambien: PharmaConnectUSA – Pharma Connect USA
https://pharmaconfiance.shop/# Pharma Confiance
http://pharmajetzt.com/# internetapotheken
ons medicatie voor apotheken: MedicijnPunt – apotheke holland
Hello navigators of purification !
What Is the Best Air Purifier for Cigarette Smoke Use? – п»їhttps://bestairpurifierforcigarettesmoke.guru/ best smoke air purifier
May you experience remarkable pristine moments !
MedicijnPunt Medicijn Punt Medicijn Punt
online-apotheke: PharmaJetzt – luitpold apotheke wГјrzburg
http://pharmajetzt.com/# Pharma Jetzt
doxycycline generics pharmacy: Pharma Connect USA – cost of cialis at pharmacy
PharmaJetzt die gГјnstigste online apotheke PharmaJetzt
klonopin pharmacy price: Pharma Connect USA – the online pharmacy
http://pharmaconfiance.com/# metronidazole et grossesse
¡Saludos, maestros del juego !
Casinos extranjeros con bonos sin depГіsito inicial – п»їhttps://casinoextranjerosdeespana.es/ casinos extranjeros
¡Que experimentes maravillosas movidas impresionantes !
http://pharmajetzt.com/# Pharma Jetzt
MedicijnPunt: medicijen – medicijn online bestellen
acheter saxenda en ligne Pharma Confiance flagyl medicament
target pharmacy clomid price: PharmaConnectUSA – best pharmacy to buy cialis
http://pharmajetzt.com/# Pharma Jetzt
shop apotheker: shop spotheke – shop apotheken
luitpold-apotheke bad steben online apotheke pille gГјnstige online apotheke
ed pharmacy viagra: best viagra pharmacy – PharmaConnectUSA
https://pharmajetzt.shop/# apotheke versand
pharmacie drakkars avis: Pharma Confiance – sender boutique
generic cialis india pharmacy generic paxil online pharmacy PharmaConnectUSA
online pharmacy usa legal: certified pharmacy online viagra – compounding pharmacy
https://pharmajetzt.shop/# online medicine
¡Hola, seguidores del éxito !
casino online fuera de EspaГ±a con bonos semanales – https://www.casinosonlinefueradeespanol.xyz/# casinos online fuera de espaГ±a
¡Que disfrutes de asombrosas triunfos épicos !
Pharma Confiance: silicium organique g5 en pharmacie – Pharma Confiance
http://medicijnpunt.com/# medicatie apotheker
Pharma Confiance Pharma Confiance prix du tadalafil 10 mg
Pharma Connect USA: medco pharmacy lipitor – legal online pharmacy review
Delve into the mysterious world of the Unknown 9, and uncover mysteries hidden in plain sight. Jestem podekscytowany, że udało nam się płynnie przekształcić aerodynamikę i styl lotniczy z samolotów w ponadczasowy zegarek. Nie tylko zachowaliśmy tradycje rzemiosła i klasyczne kody projektowania, ale także włączyliśmy wysoce ergonomiczne właściwości. To świadectwo doskonałego połączenia innowacji, dziedzictwa i funkcjonalności. bizdev@mtcgame Jeśli chcesz wysłać swoje przedmioty do innej lokalizacji, wybierz je poniżej Dostępność przedmiotów, ceny, informacje o dostawie i warunki sprzedaży zostaną zaktualizowane zgodnie z nowym miejscem wysyłki Jeśli chcesz wysłać swoje przedmioty do innej lokalizacji, wybierz je poniżej Dostępność przedmiotów, ceny, informacje o dostawie i warunki sprzedaży zostaną zaktualizowane zgodnie z nowym miejscem wysyłki
http://resurrection.bungie.org/forum/index.pl?profile=zrewcompl
Informacje o reklamach Najważniejszą rzeczą do rozważenia jest to, że aplikacja jest dostępna tylko na naszej stronie internetowej MegaPari. Nie mamy nic wspólnego z żadnym innym oprogramowaniem, którego linki do pobrania można znaleźć w zasobach stron trzecich. Nie dodaliśmy również naszej aplikacji do oficjalnego sklepu Google Play. Tylko w AppStore. Jest to jednoręki bandyta, który jako jeden z pierwszych pojawił się w kolekcji 3 Oaks Gaming na pl.topkasynoonline 3oaks-gaming i dlatego gracze mają do niego dużą sentymentalność. Sama mechanika tego automatu jest naprawdę prosta i może w niego zagrać nawet nowy gracz. Slot przygotował dla graczy aż 4 różne jackpoty, z czego największy oferuje wygraną aż 1000 x zakład gracza. Największą atrakcją maszyny są jednak darmowe spiny, które zostają uruchomione dzięki symbolom scatter. Żeby zapewnić graczom jak największe wygrane, w grze bonusowej biorą udział wyłącznie najlepiej płatne symbole. Siatka maszyny to 3 x 5, a jej RTP to 95,33%.
http://medicijnpunt.com/# apotheke online
Pharma Connect USA: viagra uk pharmacy online – PharmaConnectUSA
Pharma Confiance: cold medicine in france – pharmacie ouverte aujourd’hui strasbourg
vytorin online pharmacy Eskalith PharmaConnectUSA
https://pharmajetzt.com/# PharmaJetzt
http://pharmaconnectusa.com/# buy propecia online pharmacy
fort tonique: ordonnance viagra en ligne – Pharma Confiance
no prescription online pharmacy ua products percocet: provigil indian pharmacy – naproxen pharmacy price
gГјnstige online apotheke auf rechnung gГјnstige online apotheke PharmaJetzt
http://pharmajetzt.com/# versand apotheke auf rechnung
apotheek spanje online: Medicijn Punt – MedicijnPunt
Pharma Confiance: magasin matГ©riel mГ©dical paris 20 – Pharma Confiance
Pharma Connect USA Pharma Connect USA warfarin pharmacy protocol
¡Bienvenidos, descubridores de riquezas ocultas!
Casino online fuera de EspaГ±a sin restricciones KYC – https://casinofueraespanol.xyz/# casinofueraespanol.xyz
¡Que vivas increíbles jugadas magistrales !
https://pharmajetzt.shop/# apothe online
shop apotheje: PharmaJetzt – medikamente liefern
größte online apotheke: apotal online shop – Pharma Jetzt
pharmacie c acheter ketoderm crГЁme en ligne pharmacie plein soleil
http://pharmajetzt.com/# Pharma Jetzt
Pharma Confiance: livraison urgente mГ©dicaments lyon – Pharma Confiance
Pharma Confiance: matГ©riel mГ©dical paris 14 – Pharma Confiance
compounding pharmacy piroxicam Pharma Connect USA letrozole online pharmacy
http://pharmaconnectusa.com/# australian online pharmacy viagra
Pharma Confiance: pharmacie de garde 50 – Pharma Confiance
MedicijnPunt: apotheke nl – belgie apotheek online
Nootropil dysfunction pharmacy2u cialis
https://pharmaconnectusa.com/# PharmaConnectUSA
garancia pas cher: drakkars pharmacie – amoxicilline utilisation
¡Hola, entusiastas de la fortuna !
Los casinos online extranjeros mГЎs recomendados – https://www.casinosextranjerosdeespana.es/ mejores casinos online extranjeros
¡Que vivas increíbles recompensas extraordinarias !
medicijn online: MedicijnPunt – MedicijnPunt
PharmaJetzt shop aphotheke PharmaJetzt
https://pharmaconnectusa.com/# Pharma Connect USA
https://medicijnpunt.shop/# Medicijn Punt
aporheke: apoteken – Pharma Jetzt
https://pharmaconfiance.shop/# pharmacie à domicile
online-apotheke testsieger PharmaJetzt shops apotheke
ciprofloxacin pharmacy: clindamycin uk pharmacy – rx pharmacy symbol
¡Saludos, jugadores apasionados !
Juega en casino fuera de EspaГ±a sin comisiones – https://casinosonlinefueraespanol.xyz/# п»їcasino fuera de espaГ±a
¡Que disfrutes de tiradas afortunadas !
MedicijnPunt: medicijnen aanvragen apotheek – online apotheek zonder recept ervaringen
http://pharmaconnectusa.com/# rx care pharmacy detroit mi
https://pharmaconfiance.com/# paracetamol belgique
beauty officine montre connectГ©e douleur bras nouveau traitement helicobacter pylori 2023
gd savoir fer: grande boГ®te Г pharmacie – que reprГ©sente 50 g de croquette
Medicijn Punt: MedicijnPunt – apotheek on line
http://pharmajetzt.com/# medikament bestellen
EFarmaciaIt: cura zona spray italia – EFarmaciaIt
Rask Apotek: Rask Apotek – bomullsdotter apotek
https://raskapotek.shop/# apotek åpent julaften
Svenska Pharma Svenska Pharma Svenska Pharma
http://svenskapharma.com/# massage billigt
Papa Farma: Papa Farma – Papa Farma
Papa Farma: natysal opiniones – movicol sin receta
¡Bienvenidos, participantes de emociones !
Casino fuera de EspaГ±a con ranking de juegos – https://www.casinoporfuera.guru/ casinoporfuera.guru
¡Que disfrutes de maravillosas movidas brillantes !
Papa Farma Papa Farma Papa Farma
https://raskapotek.shop/# apotek åpent julaften
Svenska Pharma: Svenska Pharma – Svenska Pharma
https://efarmaciait.com/# trausan 30 bustine
Svenska Pharma: Svenska Pharma – apotek medicin
EFarmaciaIt EFarmaciaIt elidel crema opinioni
Rask Apotek: Rask Apotek – te tre olje apotek
lutein apotek: Rask Apotek – reisevaksine apotek
https://papafarma.shop/# viagra spain
Rask Apotek pluggen apotek leppepomade apotek
Svenska Pharma: ketonmГ¤tare apotek – Svenska Pharma
https://svenskapharma.shop/# pulse oximeter apotek
https://svenskapharma.shop/# magnesiumsulfat apotek
vanndrivende apotek: Rask Apotek – Rask Apotek
EFarmaciaIt samyr 200 compresse prezzo armolipid plus e eutirox
augmentin deutsch: migliori farmacie online – EFarmaciaIt
http://svenskapharma.com/# Svenska Pharma
¡Hola, descubridores de oportunidades!
Casino online extranjero con torneos de blackjack – https://www.casinoextranjero.es/ casinos extranjeros
¡Que vivas conquistas brillantes !
medicinas a domicilio: Papa Farma – Papa Farma
EFarmaciaIt collagene herbalife prezzo la migliore farmacia online
EFarmaciaIt: EFarmaciaIt – EFarmaciaIt
https://svenskapharma.com/# Svenska Pharma
https://papafarma.shop/# Papa Farma
EFarmaciaIt: EFarmaciaIt – bentelan quanto costa
Rask Apotek Rask Apotek Rask Apotek
munskГ¤rm apotek: hundtandkrГ¤m apotek – hemkГ¶rning apotek
http://papafarma.com/# Papa Farma
hiv hjemmetest apotek apotek Гёrevoks Rask Apotek
mitella apotek: Svenska Pharma – billig smoothie
https://efarmaciait.shop/# EFarmaciaIt
Papa Farma: natura veterinaria – 30 gramos a ml
http://svenskapharma.com/# Svenska Pharma
¡Saludos, entusiastas de la aventura !
casino online extranjero con soporte multicanal – https://casinosextranjero.es/# mejores casinos online extranjeros
¡Que vivas increíbles jackpots extraordinarios!
EFarmaciaIt: EFarmaciaIt – EFarmaciaIt
Rask Apotek Rask Apotek Rask Apotek
http://efarmaciait.com/# EFarmaciaIt
taxfree malaga: zzzquil natura opiniones – Papa Farma
Rask Apotek: hente resept pГҐ annet apotek – sГёndagsГҐpne apotek
balsoprim niГ±os para que sirve nutriben bebe farmacia g
https://svenskapharma.com/# eye primer bäst i test
dr max app: a cosa serve la crema travocort – bactroban crema equivalente prezzo
farmscias: Papa Farma – Papa Farma
https://efarmaciait.com/# EFarmaciaIt
tannbleking apotek Rask Apotek apotek ledige stillinger
lasix costo: novadien 28 giorni – EFarmaciaIt
buying drugs from canada: Canada Pharm Global – global pharmacy canada
http://medsfrommexico.com/# purple pharmacy mexico price list
¡Hola, fanáticos del riesgo !
Juega en casino por fuera sin restricciones fiscales – https://www.casinoonlinefueradeespanol.xyz/# п»їп»їcasino fuera de espaГ±a
¡Que disfrutes de asombrosas premios extraordinarios !
Meds From Mexico: medicine in mexico pharmacies – Meds From Mexico
http://indiapharmglobal.com/# indianpharmacy com
India Pharm Global: India Pharm Global – buy prescription drugs from india
canadian pharmacy king reviews Canada Pharm Global best rated canadian pharmacy
https://medsfrommexico.shop/# mexico drug stores pharmacies
canadian pharmacy prices: Canada Pharm Global – canadapharmacyonline com
http://canadapharmglobal.com/# canadian pharmacy world reviews
India Pharm Global: pharmacy website india – reputable indian pharmacies
canadian drug pharmacy canadian pharmacy canadian pharmacy world
https://medsfrommexico.shop/# Meds From Mexico
medication from mexico pharmacy: Meds From Mexico – Meds From Mexico
¡Saludos, aventureros del azar !
Mejores bonos en casinos online extranjeros hoy – п»їhttps://casinosextranjerosenespana.es/ casino online extranjero
¡Que vivas increíbles giros exitosos !
purple pharmacy mexico price list best online pharmacies in mexico Meds From Mexico
top online pharmacy india: India Pharm Global – top online pharmacy india
https://medsfrommexico.shop/# Meds From Mexico
purple pharmacy mexico price list: п»їbest mexican online pharmacies – Meds From Mexico
canadian pharmacy online reviews canadianpharmacy com best mail order pharmacy canada
https://canadapharmglobal.com/# canadian pharmacy online reviews
India Pharm Global: India Pharm Global – India Pharm Global
http://medsfrommexico.com/# Meds From Mexico
mexican border pharmacies shipping to usa: mexican mail order pharmacies – Meds From Mexico
indianpharmacy com best india pharmacy indian pharmacies safe
legit canadian online pharmacy: pharmacy canadian – canadian mail order pharmacy
Aviator Gra Hazardowa Посетите этот сайт sridemolition 2024 03 19 hello-world #comment-11779 Showcase your personality in Counter-Strike 2 (CS2) with unique weapon skins. Our store provides a wide selection, from rare to limited-edition designs, permitting you to demonstrate your style and improve your gameplay. Vänligen välj det som passar dig bäst. sweet bonanza: sweet bonanza siteleri – sweet bonanza demo sweetbonanza1st.shop W większości kasyn online terminy wpłat są zawsze natychmiastowe, którzy regularnie wpłacają pieniądze na konto w kasynie. Wiele strategii blackjacka zostało opracowanych przez lata, gry hazardowe bez depozytu w tym automaty. usacanadapharm # pharmacy canadian superstore
https://ripostecreativegironde.xyz/bacasable/?siosmegarfa1978
The official site of the Aviator game at Pin Up Casino. Aviator 1win demo for testing tactics and winning schemes. Signals and bot in aviator 1win telegram channel. Hacking aviator game for money, download on android Play Aviator 1win at the Aviator pin up casino. Download Aviator app on your Android phone. Play free aviator pin up strategy to make money. Get welcome bonus by promo code 1win aviator pin up ¡Descubre la Verdad Detrás de Plinko: ¿Es Real o Solo un Mito? La Historia y Orígenes de Plinko ¿Cómo se Juega a Plinko? Las Estrategias Detrás de Plinko Probabilidades y Matemáticas de Plinko Impacto Cultural de Plinko Pruebas y Testimonios de Jugadores ¿Es Plinko un Juego Justo? Plinko en la Era Digital Conclusión ¡Descubre la Verdad Detrás de Plinko: ¿Es Содержимое Betturkey Casino Türkiye Betturkey Giriş Betturkey Güncelle Betturkey Özellikleri Betturkey Casino Türkiye’nin Faydaları Betturkey Giriş Nasıl Yapılıyor? Ne Olanlar…
https://indiapharmglobal.com/# India Pharm Global
canadian pharmacy 365: Canada Pharm Global – canadian pharmacy 365
https://medsfrommexico.com/# Meds From Mexico
Meds From Mexico Meds From Mexico best online pharmacies in mexico
my canadian pharmacy: Canada Pharm Global – canadapharmacyonline
https://indiapharmglobal.shop/# reputable indian online pharmacy
certified canadian pharmacy: Canada Pharm Global – canadian online pharmacy
https://indiapharmglobal.shop/# buy prescription drugs from india
escrow pharmacy canada best canadian pharmacy online canadian drugs online
canadian drug: legit canadian pharmacy – online canadian pharmacy
¡Hola, buscadores de fortuna !
Casino sin licencia y sin lГmite de apuestas – п»їcasinossinlicenciaespana.es mejores casinos sin licencia en espaГ±a
¡Que experimentes rondas emocionantes !
Meds From Mexico: Meds From Mexico – Meds From Mexico
https://medsfrommexico.com/# Meds From Mexico
http://medsfrommexico.com/# Meds From Mexico
reputable mexican pharmacies online Meds From Mexico Meds From Mexico
best online canadian pharmacy: buy canadian drugs – pharmacy in canada
indianpharmacy com: indian pharmacy paypal – India Pharm Global
https://semaglupharm.com/# SemagluPharm
Order Rybelsus discreetly: Semaglu Pharm – Semaglu Pharm
Semaglu Pharm: naion semaglutide – empower pharmacy lawsuit semaglutide
https://prednipharm.shop/# prednisone 10 mg brand name
https://semaglupharm.shop/# how much is rybelsus with insurance
is lipitor bad for kidneys Affordable Lipitor alternatives USA LipiPharm
Predni Pharm: Predni Pharm – average cost of generic prednisone
https://semaglupharm.com/# Affordable Rybelsus price
Crestor Pharm CrestorPharm CrestorPharm
PredniPharm: prednisone 20mg price – PredniPharm
Lipi Pharm: lipitor and tums – atorvastatin and edibles
https://semaglupharm.shop/# Where to buy Semaglutide legally
https://semaglupharm.com/# semaglutide face
рџљЂ Hemen kaydol – sadece 1 dakikada oynamaya başla! Sweet Bonanza oyununun temel yaratılış amacı, kullanıcılara hem eğlenceli hem de dinamik bir oyun deneyimi sunmaktır. Bu oyun, renkli ve tatlı meyve simgeleriyle dikkat çekici bir görsellik sunarak, oyuncuların stres atmasına ve keyifli zaman geçirmesine olanak tanıyan bir yapıya sahiptir. Oyun içindeki fonksiyonlar, kullanıcıların hem zevk almasını hem de stratejik düşünme yeteneklerini geliştirmesini hedefler. рџљЂ Hemen kaydol – sadece 1 dakikada oynamaya başla! рџљЂ Hemen kaydol – sadece 1 dakikada oynamaya başla! Sweet Bonanza oyunu, görsel zenginliği ve sanatsal detaylarıyla oyuncular üzerinde ilk andan itibaren büyük bir etki bırakır. Renkli ve canlı tasarımı ile bilinen bu oyun, özellikle tatlı ve meyve sembollerinin kullanımıyla dikkat çeker. Bu görsel elementler, oyunun tema dünyasını geniş bir hedef kitleye çekici kılar. Oyunun grafik tasarımında, çizgi film benzeri karakterler ve parlak, göz alıcı arka planlar ön plana çıkar. Oyun tasarımında kullanılan yüksek çözünürlüklü grafikler ve dinamik animasyonlar, kullanıcının oyun deneyimini iyileştirmek için sürekli olarak güncellenir.
https://codeandsupply.co/users/tsW-OS6zomNzNA
Bazı durumlarda oyunun taktiği sayesinde kumarbazlar fazla oranda kazanabilmektedir. Sweet oyunlarında hile aramak yerine taktiklerini bulmak kumarbazlar adına daha da avantajlı olmakta ve kazandırma şansını artırmaktadır. Etorobet tüm yararlı bilgileri sitesinde sunmaktadır. Kumarbazlar bonanza oyununda ne kadar şeker patlatırsa o kadar kazanmaktadır. Ancak patlatma taktikleri de mutlaka bulunmaktadır. Bunları bilmek de kumarbazların hakkıdır. Platformun bahis yapısı genelde kazanmaya ve kazandırmaya odaklı olduğundan tüm hediyeler bedavadır. Sadece ufacık tefecik şartlarını sağladığınız takdirde bütün bonusları kapabilirsiniz. Artemisbet sweet bonanza şeker patlatma taktiği başlığı altında yapılan araştırmalarda hilenin olmadı varsayılmaktadır. Ayrıca yapılan incelemelerde hile faktörünün olmaması yönünde beyannameler bulunmaktadır. Dolayısıyla gözünü kapalı spin yaparak tüm kazançlara sahip olmanız an meselesidir.
Generic Crestor for high cholesterol Over-the-counter Crestor USA Crestor home delivery USA
prednisone 20mg price in india: Predni Pharm – PredniPharm
prednisone canada pharmacy: PredniPharm – prednisone 5mg coupon
LipiPharm atorvastatin muscle cramps Lipi Pharm
Predni Pharm: PredniPharm – prednisone 40 mg tablet
Semaglu Pharm: Semaglu Pharm – Semaglu Pharm
http://semaglupharm.com/# SemagluPharm
http://crestorpharm.com/# No doctor visit required statins
Lipi Pharm can i take magnesium glycinate with atorvastatin 5 mg lipitor
https://semaglupharm.com/# Buy Rybelsus online USA
Lipi Pharm: Affordable Lipitor alternatives USA – Discreet shipping for Lipitor
Lipi Pharm Lipi Pharm Lipi Pharm
http://semaglupharm.com/# Semaglu Pharm
ezetimibe-rosuvastatin: rosuvastatin 40 mg used for – can you just stop taking crestor
prednisone 20mg buy online: prednisone 20mg tab price – PredniPharm
Online statin therapy without RX what can you not take with rosuvastatin CrestorPharm
http://lipipharm.com/# white pill 114 atorvastatin
Affordable cholesterol-lowering pills: CrestorPharm – Safe online pharmacy for Crestor
Crestor Pharm: difference between atorvastatin and rosuvastatin – CrestorPharm
http://semaglupharm.com/# Rybelsus 3mg 7mg 14mg
microdose semaglutide how to use semaglutide SemagluPharm
PredniPharm: 1 mg prednisone daily – Predni Pharm
USA-based pharmacy Lipitor delivery: No RX Lipitor online – LipiPharm
https://semaglupharm.shop/# SemagluPharm
semaglutide glp 1 SemagluPharm Semaglu Pharm
Over-the-counter Crestor USA: Crestor Pharm – Crestor Pharm
LipiPharm: LipiPharm – Lipi Pharm
atorvastatin vs atorvastatin calcium Lipi Pharm LipiPharm
Cheap Lipitor 10mg / 20mg / 40mg: lipitor dosage range – USA-based pharmacy Lipitor delivery
prednisone cost us: Predni Pharm – PredniPharm
prednisone 10 mg price: PredniPharm – Predni Pharm
prednisone 12 tablets price ordering prednisone Predni Pharm
https://prednipharm.com/# prednisone 50 mg coupon
LipiPharm: LipiPharm – Lipi Pharm
LipiPharm Order cholesterol medication online Atorvastatin online pharmacy
what are side effects of atorvastatin: Atorvastatin online pharmacy – is 10mg of lipitor a low dose
how much is crestor without insurance: Crestor mail order USA – CrestorPharm
п»їBuy Crestor without prescription CrestorPharm Crestor Pharm
https://crestorpharm.com/# CrestorPharm
prednisone uk: prednisone 2.5 mg price – over the counter prednisone cream
Atorvastatin online pharmacy: atorvastatin rhabdomyolysis – LipiPharm
USA-based pharmacy Lipitor delivery Lipi Pharm Lipi Pharm
Semaglu Pharm: SemagluPharm – Semaglutide tablets without prescription
Lipi Pharm No RX Lipitor online atorvastatin action
http://semaglupharm.com/# Semaglu Pharm
Semaglutide tablets without prescription: Where to buy Semaglutide legally – Affordable Rybelsus price
Lipi Pharm: Online statin drugs no doctor visit – time of day to take lipitor
Semaglu Pharm No prescription diabetes meds online Semaglu Pharm
PredniPharm: Predni Pharm – PredniPharm
rybelsus dose equivalent to ozempic: No prescription diabetes meds online – Order Rybelsus discreetly
Cheap Lipitor 10mg / 20mg / 40mg: Affordable Lipitor alternatives USA – how fast does lipitor work
PredniPharm 2.5 mg prednisone daily 20 mg prednisone tablet
https://semaglupharm.com/# SemagluPharm
Predni Pharm: Predni Pharm – Predni Pharm
can you take rybelsus and januvia together: Online pharmacy Rybelsus – Rybelsus online pharmacy reviews
foods to avoid on semaglutide SemagluPharm Online pharmacy Rybelsus
Affordable Rybelsus price: SemagluPharm – Semaglutide tablets without prescription
LipiPharm LipiPharm Order cholesterol medication online
https://crestorpharm.com/# crestor lawsuits
Predni Pharm: best pharmacy prednisone – prednisone 10 mg canada
atorvastatin pronounce: No RX Lipitor online – USA-based pharmacy Lipitor delivery
Semaglu Pharm: Semaglu Pharm – SemagluPharm
semaglutide dosage chart units: Safe delivery in the US – SemagluPharm
п»їBuy Crestor without prescription CrestorPharm Safe online pharmacy for Crestor
https://lipipharm.com/# п»їBuy Lipitor without prescription USA
semaglutide & tirzepatide weight loss clinic: SemagluPharm – Semaglu Pharm
CrestorPharm: crestor 5 – Buy Crestor without prescription
Semaglu Pharm can you take rybelsus and trulicity together rybelsus diet plan
Lipi Pharm: what is the most serious side effect of atorvastatin – Lipi Pharm
Buy statins online discreet shipping: CrestorPharm – Buy statins online discreet shipping
crestor every other day: CrestorPharm – Best price for Crestor online USA
https://prednipharm.shop/# PredniPharm
prednisone 1mg purchase buy prednisone online australia 5mg prednisone
peptide sciences semaglutide: Semaglu Pharm – Online pharmacy Rybelsus
Crestor mail order USA: rosuvastatin and clopidogrel – CrestorPharm
prednisone best prices: PredniPharm – Predni Pharm
Lipi Pharm what are the side effects of atorvastatin lipitor tinnitus
This artist’s impression illustrates how high-speed jets from supermassive black holes would look. Image credit: ESA Hubble L. Calçada, ESO. Weiss, S. A., Rust, W. D., MacGorman, D. R., Bruning, E. C. & Krehbiel, P. R. Evolving complex electrical structures of the steps 25 june 2000 multicell storm. Monthly Weather Review 136, 741–756 (2008). The innovation: Lockheed Martin engineers are transforming the combat-proven Sniper® targeting pod — a staple on 4th Generation fighters worldwide — into an edge communications and computing node to enable combined joint all domain command and control. “I just remember coming away from that game, thinking in the car, how come I’m not a South Melbourne fan? I was probably too young to understand and I probably wouldn’t have been able to tell you why. That link to Ange’s football continued. I tried to watch the Young Socceroos highlights where possible when he was in charge.
https://sgtradingltd.co.uk/are-aviator-autoplay-options-fair-or-rigged-a-review-for-rwandan-players/
“Really, it was being able to have conversations with the team about the hardware, gaining an understanding of what’s gone into developing your products, that helped sell me on Meter.” If you landed here then you must have searched for examples about how you can get Dynatrace to work with Aviatrix. The easiest vpn for Chrome OS. In combination with Google single sign-on users can sign in with their Google business account and download a Chromebook compatible vpn profile in just two steps. Downloading Aviatrix is a simple process that ensures a thrilling gaming experience across different devices. Whether you are using a PC, iOS, or Android device, you can easily set up the game and start playing in no time. This guide has provided detailed steps for downloading and installing Aviatrix, as well as tips for troubleshooting common issues. Additionally, you can transition from demo to real money play and enjoy various bonuses and promotions offered by trusted online casinos. With the information provided, you are well-equipped to enjoy Aviatrix and take full advantage of the exciting features and rewards it offers.
SemagluPharm: Semaglu Pharm – Rybelsus side effects and dosage
FDA-approved Rybelsus alternative: SemagluPharm – SemagluPharm
https://vgrsources.com/# how much is a 100mg viagra
viagra tablets in india price: VGR Sources – Precio de Viagra 50 mg
generic sildenafil 25 mg: viagra where to buy canada – viagra price online
can you buy female viagra over the counter VGR Sources buy viagra cheap online
online viagra: VGR Sources – where to order real viagra
sildenafil 10 mg india: VGR Sources – cheap sildenafil 100mg
viagra triangle online viagra best viagra pill
sildenafil 10 mg: VGR Sources – buy viagra tablet online india
https://vgrsources.com/# sildenafil tablets 120 mg
order sildenafil online: where can i buy viagra over the counter in singapore – viagra gel
cost of female viagra: sildenafil 100mg uk price – buy viagra online usa
cheap sildenafil sildenafil 100mg free shipping where to order viagra online
viagra on the web: VGR Sources – buy sildenafil citrate 100mg
where can i get real viagra: viagra 30 tablet – sildenafil pharmacy
cheapest generic viagra australia: VGR Sources – viagra for sale in india
best viagra pills over the counter VGR Sources buy viagra safely online uk
viagra canada prescription: VGR Sources – where to buy viagra over the counter in usa
Pin-Up Casino pleases its customers with a generous bonus program, which includes many tempting rewards. Pin Up casino bonuses benefit beginners and more experienced players who want to take advantage of this gambling establishment’s advantages. Below is a breakdown of the main offerings: Contact support to switch personal statistics, as most online casinos limitation the ability to alter certain suggestions yourself to end ripoff. The newest PinAp players have access to an initial put extra and you will 250 100 percent free revolves during the gambling enterprise. Pin-Right up offers multiple deposit and you will withdrawal tips, along with charge cards (Charge, Charge card and you can Maestro), e-purses (Qiwi, YouMoney, VK Shell out, WebMoney), lender transmits and you can cryptocurrencies. Withdrawal out of financing will require of a short while to three months, with respect to the selected strategy.
https://faq.winbance.com/index.php/2025/06/04/can-you-customize-mines-gambling-game-heres-how/
Online casino websites provide a JetX demo that gamblers may play. Instead of risking real money in this mode, you play with fake money. In the demo mode, you may practice your gaming techniques while learning more about the game, how to bet and payout, and other pertinent information. We recommend to fill your hand and develop tactics, try different strategies in the demo mode. The amount you can win at 1XBet JetX depends on your 1xbet wager and the odds displayed at any given time. To calculate your 1xbet JetX payout, divide your total bet by 1,000 (i.e. $10 1,000 = 0.01). So if the odds are currently 3:2, you will win $0.03 for every three planes that reach their destination successfully (or $0.06 for every four planes that make it safely to their target). However, if all five planes combust before reaching their target, you lose your bet entirely.
viagra united states: VGR Sources – viagra by phone
https://vgrsources.com/# buy viagra canada
1 viagra: best female viagra tablets – viagra generic canada price
viagra prescription nz best viagra pills over the counter can i buy female viagra over the counter
viagra tablet 100 mg online: VGR Sources – viagra purchase in india
buy real viagra online no prescription: viagra pills online usa – online viagra order india
viagra super active online: VGR Sources – buy viagra usa
viagra voucher VGR Sources cheap viagra online pharmacy
sildenafil 100mg online india: cheap viagra.com – generic viagra otc
sildenafil 100mg for sale uk: VGR Sources – can you buy real viagra online
https://vgrsources.com/# generic viagra free shipping
purchase viagra mexico: order generic viagra uk – where can i order viagra online in canada
buy viagra toronto generic sildenafil pills sildenafil tablets online
viagra price mexico: viagra store – buy online viagra tablets
sildenafil cheapest price in india: buy viagra tablet india online – sildenafil without prescription from canada
can you purchase viagra in mexico: where can i get real viagra – purchase viagra in mexico
viagra brand coupon VGR Sources generic viagra usa
buy viagra with paypal: VGR Sources – best price for viagra 100 mg
online pharmacy viagra usa: VGR Sources – buy viagra online with paypal in canada
discount viagra india: real viagra online no prescription – where can you get women’s viagra
https://vgrsources.com/# generic viagra europe
where can i get real viagra online: VGR Sources – brand viagra price
order viagra soft VGR Sources female viagra buy online in india
sildenafil pills in india: buy cheap viagra from india – sildenafil 50mg tablets coupon
viagra 400mg online: VGR Sources – generic viagra pills online
buy viagra for female online: viagra for women otc – female viagra capsule
buy generic viagra soft tabs viagra canadian pharmacy viagra generic without prescription
cost of 100mg viagra pill: VGR Sources – sildenafil 100mg usa cheap
female viagra canadian pharmacy: VGR Sources – generic viagra for sale cheap
https://vgrsources.com/# usa viagra 100
how to purchase viagra in india VGR Sources how can i get viagra
order viagra india: purchase sildenafil pills – best viagra tablet price in india
generic sildenafil 40 mg: VGR Sources – pfizer online viagra
viagra costa rica cheapest sildenafil 100 mg online viagra miami
order viagra mexico: 711 viagra pills – buying viagra online illegal
viagra 5mg price: viagra cheap – cheap viagra india
https://vgrsources.com/# generic viagra cost
canadian pharmacy generic viagra 100mg VGR Sources buy sildenafil tablets online
discount viagra canadian pharmacy: VGR Sources – female viagra tablets price
buy female viagra pills in india: viagra nz buy – viagra soft tabs 100mg pills
Wo kann ich generisches Viagra online bestellen? VGR Sources viagra rx pharmacy
average cost of viagra prescription: order sildenafil canada – viagra generico
sildenafil pills canada: viagra tablets over the counter – sildenafil 20 mg tablet
https://vgrsources.com/# can i buy viagra online in uk
sun pharmacy india buy viagra online in india career after b pharmacy in india
order medicine online india: india rx – medplus pharmacy india
mexican pharmacy for cialis Pharm Mex over the counter drugs mexico
online pharmacy in india InPharm24 online medical store india
п»їindia pharmacy: InPharm24 – pharmacy website in india
kmart store pharmacy pharmacy 2 home finpecia rx pharmacy online
https://pharmmex.com/# can you buy ozempic in mexico
ozempic online mexico: international online pharmacies – my mexican pharmacy reviews
Whether you’re new to the avaitor game or a seasoned player seeking to refine your approach, understanding different betting strategies can significantly impact your results. The key lies in knowing when to cash out and how to manage your bankroll effectively. Let’s explore some practical strategies that Players can implement immediately to potentially increase their winnings in this exciting aveter game. The maximum possible win in JetX is $10K. The specific JetX prediction for each individual player depends on what bets they make, use strategies, and how the game as a whole is shaping up. Intuition, the right tactics, and luck will ultimately determine how much you can earn in JetX. JetX, developed by SmartSoft, is one of the most captivating online casino-games available to players in Brazil. Known for its fast-paced gameplay and potential for high wins, JetX demands a smart approach to maximize your experience. Whether you are a beginner or a seasoned player, deploying different strategies while playing JetX can significantly influence your results. This review explores what you can expect by adopting various strategies in this popular casino game.
https://residencialconstrutora.com.br/how-to-do-upi-withdrawals-from-lucky-jet-the-right-way/
Play, win, and celebrate with Big Mumbai Game—where luck meets opportunity! F70943602DD8603C1527D46FAC69510C A big no for them We Didn’t Charge Any Money For Kolkata FF Tips, and the Result is free for everyone. Moreover, people still don’t know that there’s a really easy solution on the web. This website is the best way of checking results online on time and getting some Kolkata FF tricks too. F70943602DD8603C1527D46FAC69510C One of the best features of Raja Luck is that new players get a 777 free bonus just for signing up. This bonus can be used to start playing and trying out the different games without any initial investment. Apart from the initial bonus, the app also offers daily gift codes, giving players additional chances to earn rewards. The legality of Raja Game depends on your location, as online betting and gaming laws vary by region. In India, games like color prediction and lottery are often considered games of chance, which might not be strictly regulated in every state. Always ensure you’re complying with local laws when playing these types of games.
online pharmacy in usa ozempic otc mexico lumbar spine pain management houston
adderall xr mexican pharmacy: mexican penicillin pills – medicines mexico
online mexican pharmacy: Pharm Mex – medication in mexico
Una gran noticia para este juego de penaltis es la posibilidad de jugar en dispositivos móviles, además de en PC. Esta versión del juego se adapta perfectamente a pantallas más pequeñas y le permite acceder a las funciones con mayor facilidad. Sausage party una guía de juego y consejos la letra A multiplicará tu apuesta por 10, pero los jugadores mismos no fueron las víctimas hasta mucho más tarde. La respuesta está en sus características especiales, certificar los sitios de juego y proteger los intereses de los jugadores. En la primera entrada, debe comprender la teoría fundamental detrás de jugar al póquer. Esos tres Caballos en los carretes 2, un sitio web fácil de navegar. “El Atlético de Madrid consultó a la UEFA por el incidente que provocó la anulación del penalti lanzado por Julián Álvarez al final del partido de ayer de la UEFA Champions League contra el Real Madrid.
https://blowkarten.nl/2025/06/03/es-real-que-balloon-app-paga-opinion-de-jugadores-guatemaltecos/
El juego Lucky Jet combina emoción y azar. Ha inspirado a los jugadores a desarrollar diferentes estrategias. Éstas aumentarán las posibilidades de éxito. Aunque la suerte juega un papel clave, estas tácticas están diseñadas para proporcionar cierto control y dirección en el emocionante mundo de Lucky Jet en 1win Casino. Al descargar Lucky Jet tendrás acceso al catálogo completo de juegos rápidos de 1win, así como a miles de tragamonedas y juegos de mesa online y en vivo. Veamos tres ejemplos de juegos rápidos con dinámicas simples que también te permiten multiplicar tu dinero fácilmente: En el mundo de los juegos de choque como Lucky Jet, los jugadores suelen discutir las estrategias de juego. Veamos algunas tácticas. A menudo se discuten, pero requieren un enfoque cuidadoso.
inhousepharmacy biz domperidone compounding pharmacy piroxicam simvastatin kmart pharmacy
mexican pharmacy ozempic: mexican pharmacy los algodones – can you buy viagra over the counter in mexico
http://inpharm24.com/# apotheke academy
mexico medicine: ozempic overseas pharmacy – pharmacy stores online
provigil no prescription online pharmacy Pharm Express 24 cheap viagra online pharmacy prescription
sildenafil citrate online pharmacy: pharmacy direct gabapentin – rx pharmacy no prescription
phendimetrazine online pharmacy: azithromycin online pharmacy no prescription – thriftway pharmacy store locator
medicine from india medlife pharmacy e pharmacy india
pharmacy india online: InPharm24 – doctor of pharmacy in india
https://pharmmex.shop/# mexican pills for pain
where to buy viagra in malaysia pharmacy rx to go pharmacy league city princeton u store pharmacy
xalatan online pharmacy: Pharm Express 24 – pharmacy choice ibuprofen
divya pharmacy india pharmacy council of india buy drugs from india
medlife pharmacy: india pharmacy website – best pharmacy in india
buy ozempic in mexico: can you get adderall at mexican pharmacy – azithromycin over the counter mexico
https://pharmmex.shop/# mexican pharmacies online
tirzepatide in mexico price Pharm Mex mexican pharmacy mail order
farmacia online estados unidos: best mexican pharmacy – can you get adderall at a mexican pharmacy?
retail pharmacy market in india medicines online india pharmacy india
http://pharmmex.com/# mexican pharmacy cozumel
https://inpharm24.com/# best indian pharmacy
medications for sale: hispanic pharmacy – pain medicine in houston
motion sickness online pharmacy usa indian pharmacy
https://farmaciasubito.com/# aerius 5 mg prezzo
farmacia online sconti: ozempic price – oki prezzo 30 bustine 80 mg
farmacia online la india tu farmacia online 24h comprar pastilla anticonceptiva sin receta
nerisone equivalent sans ordonnance: cystite ordonnance – achat viagra
ordonnance beautГ© exemple egoviril en pharmacie sans ordonnance en france collyre ordonnance
quanto costa la cardioaspirina senza ricetta: feldene fiale – vea olio a cosa serve
http://farmaciasubito.com/# oftaquix collirio prezzo
comprar selincro sin receta comprar viagra en alicante sin receta de la rosa tirado, ГЎngel farmacia online: comprar productos de parafarmacia a domicilio.
se puede comprar suniderma sin receta: comprar deprax sin receta – farmacia venta online valencia
farmacia bagnolo cremasco Farmacia Subito gocce minias
finasteride en ligne: malarone sans ordonnance – bain de bouche pharmacie sans ordonnance
cialis 5 mg 28 compresse prezzo: Farmacia Subito – farmacia espana online
https://pharmacieexpress.shop/# viagra en france
pyralvex solution: scrub mask Рemla cr̬me sans ordonnance
equivalent tramadol sans ordonnance Pharmacie Express arginine en pharmacie sans ordonnance
comprar pildora del dia despues sin receta: productos farmacia 24 horas online – puedo comprar canesten v sin receta
fiables sildenafil farmacia online malaga: Confia Pharma – guantes de latex farmacia online
http://confiapharma.com/# grado farmacia online espaГ±a
isotretinoina 20 mg: Farmacia Subito – etoricoxib 90 mg prezzo
crema emla prezzo Farmacia Subito dibase flaconcini
farmacia vazquez zaragoza online: Confia Pharma – farmacia veterinaria online chile
monuril cistite: prezzo colecalciferolo 50000 argento proteinato bambini
la vitamina b12 se puede comprar sin receta: se pueden comprar antibioticos sin receta – comprar stopcold sin receta
farmacia cruz verde online Confia Pharma como funciona una farmacia online
https://farmaciasubito.shop/# progeffik 200 prezzo con ricetta
donde comprar tadalafil sin receta: Confia Pharma – farmacia soler online
roger gallet fleur d’osmanthus 100 ml gel erectil en pharmacie sans ordonnance vemedia gommage filorga
comprimГ©s cortisone sans ordonnance Pharmacie Express pharmacie canada sans ordonnance
https://farmaciasubito.com/# formistin gocce bambini prezzo
farmacia canarias online: puedo comprar antihistamГnicos sin receta – se puede comprar amoxidal sin receta
farmacia bilbao online comprar rubifen sin receta espaГ±a naproxeno se puede comprar sin receta
xatral prezzo con ricetta: nebicina 150 – sonirem gocce senza ricetta
farmacia polonia online Confia Pharma app farmacia online
https://farmaciasubito.shop/# punture pappataci immagini
comprar misoprostol sin receta Confia Pharma farmacia online cuiaba
farmacia online germania: Farmacia Subito – intrarosa ovuli vendita online
m̩latonine en pharmacie sans ordonnance: Pharmacie Express Рviagra sans ordonnance pharmacie paris
http://pharmacieexpress.com/# Г©ther pharmacie sans ordonnance
embryolisse comprar farmacia online comprar viagra sin receta lleida farmacia pedidos online
monuril en pharmacie sans ordonnance: cmu pharmacie sans ordonnance – viagra homme sans ordonnance en pharmacie
comprar tiadipona sin receta: comprar antibiotico – cytotec se puede comprar sin receta medica
econazole pharmacie sans ordonnance Pharmacie Express medicament ordonnance securisee
https://pharmacieexpress.shop/# comprimГ© d’iode sans ordonnance
The life of our consumers through varied innovative products. Healthier & Delicious The push to strike a balance between today and the future is imbibed in the way we work. This keeps me on my toes! It makes me think agile and think responsibly as well. The life of our consumers through varied innovative products. « Zydus Wellness believes in building people capabilities. A steep learning curve exploring three different and impactful roles in the span of four years has given me the opportunity to lead distinct functional verticals early on in my career. » The life of our consumers through varied innovative products. The life of our consumers through varied innovative products. The push to strike a balance between today and the future is imbibed in the way we work. This keeps me on my toes! It makes me think agile and think responsibly as well.
https://cctvmerkezi.com/the-color-trading-chart-that-can-predict-your-next-win-a-review-of-tadagamings-colour-trading-game.html
The Royal x Casino IOS version can be downloaded by clicking this iOS download button and then navigating to the app store. Junglee is a free poker game that offers players a pleasant gaming experience through its well-designed gameplay. The game eliminates all the annoying ads you usually find in other games. With this easy-to-use game, you can feel the thrill of live card games anywhere and anytime, and it’s best for beginners. A full version program for Android, by Garia Games. In Softonic we scan all the files hosted on our platform to assess and avoid any potential harm for your device. Our team performs checks each time a new file is uploaded and periodically reviews files to confirm or update their status. This comprehensive process allows us to set a status for any downloadable file as follows:
gaspan prezzo: Farmacia Subito – keforal 500 per cani prezzo
el parche anticonceptivo se puede comprar sin receta farmacia online mascarillas ffp2 el hierro se puede comprar sin receta
Viagra generique en pharmacie acheter Viagra sans ordonnance viagra sans ordonnance
http://kampascher.com/# kamagra pas cher
achat kamagra kamagra livraison 24h acheter Kamagra sans ordonnance
viagra en ligne livraison rapide Viagra en France commander Viagra discretement
https://kampascher.shop/# commander Kamagra en ligne
trouver un mГ©dicament en pharmacie cialis prix Cialis generique sans ordonnance
http://viasansordonnance.com/# Acheter du Viagra sans ordonnance
Meilleur Viagra sans ordonnance 24h: commander Viagra discretement – prix bas Viagra generique
Acheter Cialis cialis prix cialis generique
pharmacie en ligne sans ordonnance pharmacie en ligne pharmacie en ligne fiable
https://kampascher.shop/# kamagra 100mg prix
commander sans consultation medicale: pharmacie en ligne – pharmacie en ligne livraison europe
kamagra livraison 24h: kamagra oral jelly – Kamagra oral jelly pas cher
Acheter Cialis Cialis generique sans ordonnance Cialis sans ordonnance 24h
pharmacie en ligne sans prescription: commander sans consultation medicale – Pharmacie Internationale en ligne
Cialis generique sans ordonnance Cialis sans ordonnance 24h Acheter Cialis 20 mg pas cher
https://viasansordonnance.shop/# livraison rapide Viagra en France
cialis sans ordonnance: commander Cialis en ligne sans prescription – Acheter Cialis 20 mg pas cher
Meilleur Viagra sans ordonnance 24h acheter Viagra sans ordonnance commander Viagra discretement
Viagra vente libre pays: Meilleur Viagra sans ordonnance 24h – viagra sans ordonnance
kamagra pas cher Kamagra oral jelly pas cher achat kamagra
achat kamagra: kamagra en ligne – kamagra oral jelly
https://viasansordonnance.com/# Viagra sans ordonnance 24h
Notation : 4.8 5 (11 votes) Penalty Shoot Out Street est un mini-jeu instantané. Lancé en juillet 2023 par Evoplay, il fait suite à un jeu de foot à succès du même éditeur : Penalty Shoot Out. Élément de comparaison Engage players by allowing them to bet on which row the ball will hit (3 rows available). Toutefois, si vous désirez vous mettre à jouer à ce jeu tout en bénéficiant d’un accompagnement de choix, décidez vous entre deux excellents casinos en ligne : Penalty Shoot Out Street est comme une évolution du jeu Penalty Shoot Out, effectivement car initialement lancé par Evoplay en mai 2020. Fort du succès retentissant de sa première version, l’équipe de développement d’Evoplay a décidé de repousser les limites en juillet 2023 avec cette nouvelle itération. Le concept vous plonge dans l’univers des tirs au but sur un terrain de quartier, doté d’un moteur de jeu plus puissant. Car à la manière d’un jeu de démineur, chaque joueur peut choisir précisément l’emplacement de son tir, relevant le défi de vaincre le gardien pour décrocher un multiplicateur associé. La victoire s’obtient en effectuant un retrait ou en concluant la séance de tirs au but.
https://redtronixautomation.com/pourquoi-penalty-shoot-out-devoplay-seduit-tant-les-joueurs-francais/
Penalty Shootout est un jeu amusant et rapide, facile à prendre en main et à jouer. Bien qu’il n’y ait pas beaucoup de stratégie, il est tout de même important de comprendre les différents paris et leurs paiements et probabilités correspondants. Avec un peu d’entraînement, vous pouvez apprendre à maximiser vos chances de gagner et repartir avec un bon bénéfice. Emportez l’excitation du roi du sport sur votre appareil avec ce jeu de lancer et d’arrêter des pénalités. Choisissez si vous voulez rivaliser avec la machine ou avec un autre joueur grâce à l’option multijoueur. Ensuite, sélectionnez une équipe et soyez prêt à introduire le ballon dans le but ou à l’arrêter. Le premier qui réussit à marquer trois points gagne la partie. 18+, nouveaux clients uniquement, conditions générales applicables, jouez de manière responsable
Cialis pas cher livraison rapide: Acheter Cialis – cialis prix
Kamagra oral jelly pas cher: kamagra gel – commander Kamagra en ligne
Viagra sans ordonnance 24h SildГ©nafil 100 mg sans ordonnance livraison rapide Viagra en France
Cialis pas cher livraison rapide: Cialis pas cher livraison rapide – pharmacie en ligne france livraison internationale
kamagra en ligne kamagra gel acheter kamagra site fiable
Acheter Cialis: Cialis generique sans ordonnance – commander Cialis en ligne sans prescription
https://viasansordonnance.com/# viagra sans ordonnance
kamagra livraison 24h: pharmacie en ligne sans ordonnance – Kamagra oral jelly pas cher
Meilleur Viagra sans ordonnance 24h viagra sans ordonnance livraison rapide Viagra en France
pharmacie en ligne france fiable: pharmacie en ligne livraison europe – Cialis pas cher livraison rapide
acheter Cialis sans ordonnance: Cialis générique sans ordonnance – commander Cialis en ligne sans prescription
Viagra gГ©nГ©rique sans ordonnance en pharmacie livraison rapide Viagra en France viagra sans ordonnance
http://pharmsansordonnance.com/# pharmacie en ligne fiable
Viagra sans ordonnance 24h: Meilleur Viagra sans ordonnance 24h – Acheter du Viagra sans ordonnance
kamagra gel: commander Kamagra en ligne – livraison discrete Kamagra
pharmacie en ligne sans ordonnance pharmacie en ligne sans ordonnance Achat mГ©dicament en ligne fiable
cialis prix: traitement ED discret en ligne – cialis sans ordonnance
acheter Kamagra sans ordonnance: pharmacie en ligne france livraison internationale – achat kamagra
commander Cialis en ligne sans prescription commander Cialis en ligne sans prescription commander Cialis en ligne sans prescription
https://ciasansordonnance.shop/# commander Cialis en ligne sans prescription
acheter Cialis sans ordonnance: Cialis pas cher livraison rapide – Cialis sans ordonnance 24h
Viagra generique en pharmacie acheter Viagra sans ordonnance Viagra sans ordonnance 24h
pharmacie en ligne fiable: commander sans consultation médicale – pharmacie en ligne france
Achat mГ©dicament en ligne fiable: pharmacie en ligne france livraison belgique – Acheter Cialis 20 mg pas cher
https://ciasansordonnance.shop/# Cialis generique sans ordonnance
Viagra homme prix en pharmacie sans ordonnance Viagra generique en pharmacie commander Viagra discretement
commander sans consultation médicale: pharmacie en ligne sans prescription – vente de médicament en ligne
pharmacie en ligne sans prescription: Pharmacies en ligne certifiees – pharmacies en ligne certifiГ©es
Viagra sans ordonnance 24h: viagra sans ordonnance – viagra en ligne
acheter kamagra site fiable kamagra en ligne kamagra oral jelly
Viagra sans ordonnance 24h: prix bas Viagra generique – Viagra generique en pharmacie
https://pharmsansordonnance.com/# pharmacie en ligne
pharmacie internet fiable France: pharmacie en ligne pas cher Рpharmacies en ligne certifi̩es
acheter Kamagra sans ordonnance kamagra gel trouver un mГ©dicament en pharmacie
Licensed online pharmacy AU pharmacy online australia Online drugstore Australia
http://eropharmfast.com/# Ero Pharm Fast
cheapest antibiotics buy antibiotics online uk get antibiotics quickly
Pharm Au24 Licensed online pharmacy AU online pharmacy australia
https://eropharmfast.com/# affordable ed medication
buy antibiotics online buy antibiotics online get antibiotics quickly
https://pharmau24.shop/# Online medication store Australia
Ero Pharm Fast ed medications cost how to get ed meds online
http://pharmau24.com/# Discount pharmacy Australia
buy antibiotics online: buy antibiotics online – Over the counter antibiotics for infection
buy antibiotics from canada Biot Pharm buy antibiotics over the counter
buy antibiotics for uti: buy antibiotics online uk – best online doctor for antibiotics
https://eropharmfast.shop/# п»їed pills online
PharmAu24: PharmAu24 – Medications online Australia
Ero Pharm Fast: cheapest online ed treatment – Ero Pharm Fast
PharmAu24: Licensed online pharmacy AU – Pharm Au24
buy antibiotics: buy antibiotics online – best online doctor for antibiotics
http://biotpharm.com/# get antibiotics quickly
Ero Pharm Fast: Ero Pharm Fast – what is the cheapest ed medication
Meanwhile, Mr Musk also welcomed twins with Shivon Zilis in November 2021 – one month before his second child with Grimes. The Tesla and SpaceX CEO also has five children – Griffin, Vivian, Kai, Saxon and Damian – with Canadian author Justine Wilson. And it’s not just about the photography or video footage. Graphic elements are another way to evoke emotions in your football social media posts. For example, you can use less text but much larger fonts to stir up excitement or joy. Another idea is to position your branded elements and player photos in a way that adds passion and energy to your graphics. See some content ideas below from two football clubs. Uptodown is a multi-platform app store specialized in Android. Our goal is to provide free and open access to a large catalog of apps without restrictions, while providing a legal distribution platform accessible from any browser, and also through its official native app.
https://stantiziching1980.iamarrows.com/https-powerballs-co
The best hackers of HTB Rumi Slots Game is the best online real earning app for card lovers, download the latest version and enjoy playing the games. You are using anoutdated browser. Pleaseupgrade your browser to improve your experience. Antofagasta and Anglo American both said that their mines were operating with generators. Hacking Battlegrounds is as wonderful and thrilling as advertised, with various types of attacks and vulnerabilities. Great opportunity to learn how to attack and defend at the same time. I find it very interesting and entertaining to spend my weekends on and play with my friends. It is surely one the best Hack The Box features. I love it. Mines is an easy-to-play online casino game that can be found at many top casinos. However, we do not recommend this low RTP, adjustable volatility, and mine-themed game.
http://biotpharm.com/# Over the counter antibiotics pills
http://biotpharm.com/# buy antibiotics from canada
pharmacy online australia: Buy medicine online Australia – Online medication store Australia
best online doctor for antibiotics: buy antibiotics from canada – get antibiotics quickly
Buy medicine online Australia: PharmAu24 – Online medication store Australia
http://biotpharm.com/# Over the counter antibiotics pills
pharmacy online australia: Buy medicine online Australia – Licensed online pharmacy AU
Ero Pharm Fast: erectile dysfunction medication online – Ero Pharm Fast
erectile dysfunction medications online: best online ed meds – Ero Pharm Fast
online pharmacy australia: Online medication store Australia – Pharm Au24
http://eropharmfast.com/# ed meds online
Online drugstore Australia: PharmAu24 – PharmAu24
affordable ed medication: Ero Pharm Fast – Ero Pharm Fast
get antibiotics without seeing a doctor: over the counter antibiotics – over the counter antibiotics
cheap erectile dysfunction pills: cheap erection pills – low cost ed meds
https://tadalaccess.com/# cialis 20 mg from united kingdom
canadian cialis: cialis samples for physicians – cialis payment with paypal
https://tadalaccess.com/# cialis tadalafil tablets
buy cialis without a prescription: cialis ingredients – cialis 20 mg coupon
how long for cialis to take effect: TadalAccess – cialis 10mg ireland
https://tadalaccess.com/# mint pharmaceuticals tadalafil reviews
https://tadalaccess.com/# where to buy liquid cialis
cialis softabs online: TadalAccess – whats the max safe dose of tadalafil xtenda for a healthy man
https://tadalaccess.com/# cialis free trial coupon
cialis 20 mg best price: canadian cialis 5mg – cialis 5mg cost per pill
https://tadalaccess.com/# cialis free
is tadalafil peptide safe to take: pharmacy 365 cialis – max dosage of cialis
https://tadalaccess.com/# canadian cialis 5mg
cialis reviews photos: Tadal Access – walmart cialis price
cialis insurance coverage: Tadal Access – cialis online canada ripoff
https://tadalaccess.com/# cialis canadian pharmacy
cialis online without perscription: cheap cialis for sale – is generic cialis available in canada
https://tadalaccess.com/# how to buy tadalafil
cialis where to buy in las vegas nv: cialis tablet – buy cialis in canada
https://tadalaccess.com/# buy generic cialiss
cialis generic timeline 2018: cialis w/o perscription – cialis over the counter at walmart
https://tadalaccess.com/# how much does cialis cost with insurance
cialis how to use: cialis coupon online – cialis prescription cost
what is the active ingredient in cialis: TadalAccess – cialis commercial bathtub
what is cialis good for: tadalafil review forum – mambo 36 tadalafil 20 mg
when will cialis become generic: TadalAccess – cialis no perscription overnight delivery
https://tadalaccess.com/# price of cialis in pakistan
cialis online without a prescription: Tadal Access – how much is cialis without insurance
reliable source cialis: Tadal Access – cialis tadalafil tablets
https://tadalaccess.com/# is tadalafil the same as cialis
dapoxetine and tadalafil: tadalafil lowest price – cialis 5mg daily
order cialis no prescription: Tadal Access – cialis no perscription overnight delivery
https://tadalaccess.com/# cialis from india
cialis for sale toronto: Tadal Access – cialis usa
https://tadalaccess.com/# cialis prices
where to buy generic cialis ?: Tadal Access – cialis super active real online store
https://tadalaccess.com/# cialis tablets for sell
tadalafil online canadian pharmacy: cialis dosage for bph – cialis once a day
cialis 5 mg for sale: Tadal Access – were can i buy cialis
https://tadalaccess.com/# cialis by mail
over the counter cialis: Tadal Access – cialis san diego
https://tadalaccess.com/# canadian pharmacy cialis
does cialis make you last longer in bed: TadalAccess – cialis ontario no prescription
https://tadalaccess.com/# tadalafil 40 mg with dapoxetine 60 mg
cialis effect on blood pressure: too much cialis – generic tadalafil 40 mg
https://tadalaccess.com/# cialis tadalafil 20 mg
overnight cialis: buying cialis online canadian order – does tadalafil lower blood pressure
https://tadalaccess.com/# cialis strength
cialis free trial phone number: what is the cost of cialis – 20 mg tadalafil best price
active ingredient in cialis: Tadal Access – sildalis sildenafil tadalafil
https://tadalaccess.com/# stendra vs cialis
https://tadalaccess.com/# over the counter cialis 2017
tadalafil (megalis-macleods) reviews: TadalAccess – when will generic cialis be available in the us
cialis side effect: typical cialis prescription strength – usa peptides tadalafil
https://tadalaccess.com/# buy cialis generic online 10 mg
u.s. pharmacy prices for cialis: cialis 40 mg – cialis onset
order cialis canada: max dosage of cialis – cialis precio
https://tadalaccess.com/# cialis onset
generic cialis 5mg: where can i buy cialis online in australia – cialis 5mg best price
https://tadalaccess.com/# cialis no perscrtion
what is cialis prescribed for: TadalAccess – buying cialis in mexico
cialis instructions: cialis 20 mg price walgreens – what is cialis tadalafil used for
https://tadalaccess.com/# buy cialis tadalafil
take cialis the correct way: Tadal Access – cialis amazon
https://tadalaccess.com/# cialis generic best price that accepts mastercard
cialis at canadian pharmacy: TadalAccess – tadalafil dose for erectile dysfunction
https://tadalaccess.com/# tadalafil ingredients
cialis 40 mg reviews: Tadal Access – best price on generic cialis
buy generic tadalafil online cheap: TadalAccess – buy cialis free shipping
https://tadalaccess.com/# adcirca tadalafil
buy liquid tadalafil online: Tadal Access – cialis generico
https://tadalaccess.com/# cialis over the counter at walmart
original cialis online: TadalAccess – vardenafil tadalafil sildenafil
cialis by mail: TadalAccess – does cialis make you harder
https://tadalaccess.com/# buying cheap cialis online
https://tadalaccess.com/# cialis daily review
over the counter cialis 2017: best place to get cialis without pesricption – what is cialis used to treat
cialis 20mg tablets: cheap cialis 20mg – cialis 5mg how long does it take to work
https://tadalaccess.com/# do you need a prescription for cialis
canadian cialis no prescription: TadalAccess – buy cialis without a prescription
cialis buy online: TadalAccess – canadian pharmacy cialis
https://tadalaccess.com/# when to take cialis 20mg
ambrisentan and tadalafil combination brands: tadalafil long term usage – cialis from canada
https://tadalaccess.com/# cialis tadalafil online paypal
generic tadalafil canada: TadalAccess – cialis covered by insurance
https://tadalaccess.com/# cialis package insert
price of cialis in pakistan: order generic cialis – cialis side effects with alcohol
cialis for daily use side effects: TadalAccess – cialis experience
https://tadalaccess.com/# what cialis
vardenafil and tadalafil: cialis 5 mg tablet – does tadalafil lower blood pressure
how to take cialis: Tadal Access – cialis prescription online
https://tadalaccess.com/# cialis manufacturer coupon 2018
tadalafil vs sildenafil: cialis high blood pressure – side effects cialis
best price on cialis 20mg: TadalAccess – order cialis canada
https://tadalaccess.com/# side effects cialis
cialis images: Tadal Access – tadalafil from nootropic review
prednisone uk: PredniHealth – PredniHealth
https://clomhealth.com/# where buy clomid price
canadian pharmacy amoxicillin: amoxicillin 50 mg tablets – Amo Health Care
PredniHealth: PredniHealth – PredniHealth
https://prednihealth.shop/# over the counter prednisone pills
prednisone 10 mg tablet: prednisone otc uk – PredniHealth
http://clomhealth.com/# buying generic clomid price
amoxicillin 500mg tablets price in india: amoxicillin price without insurance – Amo Health Care
https://amohealthcare.store/# where to get amoxicillin over the counter
Amo Health Care: cost of amoxicillin prescription – amoxicillin 500 tablet
where to buy clomid pill: Clom Health – can i buy clomid without insurance
https://clomhealth.com/# buy generic clomid without insurance
get clomid without rx: cost generic clomid without insurance – can i get clomid no prescription
cost cheap clomid pills: Clom Health – how to buy clomid without prescription
amoxicillin order online: can you buy amoxicillin uk – cost of amoxicillin
https://clomhealth.shop/# clomid without rx
order cheap clomid: can i purchase clomid without rx – how can i get cheap clomid without dr prescription
PredniHealth: PredniHealth – 50 mg prednisone canada pharmacy
get cheap clomid: Clom Health – can i get clomid without dr prescription
https://amohealthcare.store/# amoxicillin without a prescription
Amo Health Care: amoxicillin 200 mg tablet – Amo Health Care
can i buy prednisone online without prescription: PredniHealth – PredniHealth
Amo Health Care: amoxicillin capsules 250mg – Amo Health Care
https://clomhealth.shop/# cheap clomid without insurance
Amo Health Care: medicine amoxicillin 500 – amoxicillin no prescipion
Amo Health Care: amoxicillin online canada – Amo Health Care
affordable ED medication: reliable online pharmacy Cialis – best price Cialis tablets
http://maxviagramd.com/# order Viagra discreetly
Modafinil for sale: buy modafinil online – legal Modafinil purchase
doctor-reviewed advice: doctor-reviewed advice – purchase Modafinil without prescription
reliable online pharmacy Cialis: affordable ED medication – online Cialis pharmacy
https://zipgenericmd.com/# reliable online pharmacy Cialis
buy generic Viagra online: buy generic Viagra online – best price for Viagra
reliable online pharmacy Cialis: FDA approved generic Cialis – online Cialis pharmacy
https://zipgenericmd.shop/# order Cialis online no prescription
modafinil pharmacy: doctor-reviewed advice – modafinil pharmacy
safe modafinil purchase: doctor-reviewed advice – safe modafinil purchase
https://zipgenericmd.com/# cheap Cialis online
cheap Cialis online: buy generic Cialis online – online Cialis pharmacy
legit Viagra online: fast Viagra delivery – no doctor visit required
legal Modafinil purchase: Modafinil for sale – verified Modafinil vendors
http://modafinilmd.store/# doctor-reviewed advice
generic tadalafil: reliable online pharmacy Cialis – FDA approved generic Cialis
safe online pharmacy: same-day Viagra shipping – fast Viagra delivery
buy generic Viagra online: secure checkout Viagra – generic sildenafil 100mg
http://maxviagramd.com/# secure checkout Viagra
buy modafinil online: buy modafinil online – buy modafinil online
modafinil 2025: buy modafinil online – buy modafinil online
buy generic Viagra online buy generic Viagra online buy generic Viagra online
Cialis without prescription: best price Cialis tablets – Cialis without prescription
secure checkout ED drugs: best price Cialis tablets – FDA approved generic Cialis
https://modafinilmd.store/# modafinil pharmacy
affordable ED medication: generic tadalafil – FDA approved generic Cialis
safe modafinil purchase: safe modafinil purchase – modafinil 2025
Modafinil for sale: safe modafinil purchase – buy modafinil online
Modafinil for sale: safe modafinil purchase – buy modafinil online
http://maxviagramd.com/# order Viagra discreetly
https://modafinilmd.store/# safe modafinil purchase
modafinil 2025: buy modafinil online – modafinil 2025
same-day Viagra shipping: Viagra without prescription – safe online pharmacy
fast Viagra delivery no doctor visit required trusted Viagra suppliers
https://zipgenericmd.com/# FDA approved generic Cialis
FDA approved generic Cialis: order Cialis online no prescription – FDA approved generic Cialis
modafinil pharmacy: doctor-reviewed advice – legal Modafinil purchase
trusted Viagra suppliers: fast Viagra delivery – secure checkout Viagra
cheap Cialis online discreet shipping ED pills generic tadalafil
discreet shipping ED pills: online Cialis pharmacy – generic tadalafil
order Viagra discreetly: safe online pharmacy – trusted Viagra suppliers
legit Viagra online: order Viagra discreetly – legit Viagra online
https://zipgenericmd.com/# generic tadalafil
modafinil 2025: doctor-reviewed advice – Modafinil for sale
reliable online pharmacy Cialis Cialis without prescription reliable online pharmacy Cialis
safe online pharmacy: discreet shipping – discreet shipping
https://maxviagramd.shop/# no doctor visit required
http://pinupaz.top/# pin up casino
вавада официальный сайт: vavada вход – vavada casino
pin up az pin up casino pin up
пин ап зеркало: пин ап зеркало – пин ап зеркало
http://pinuprus.pro/# пин ап казино официальный сайт
пин ап казино официальный сайт: пинап казино – пинап казино
вавада казино вавада вавада
pin-up: pin-up casino giris – pin-up casino giris
http://vavadavhod.tech/# вавада официальный сайт
vavada: vavada вход – вавада официальный сайт
пин ап казино пин ап казино пин ап зеркало
pin up casino: pin-up casino giris – pinup az
https://pinuprus.pro/# пинап казино
http://pinupaz.top/# pin-up casino giris
pin up azerbaycan: pinup az – pin-up
pin-up pin-up casino giris pinup az
pin up azerbaycan: pin up azerbaycan – pin up
vavada вход: вавада зеркало – вавада зеркало
pin up casino pin up casino pin-up casino giris
пин ап казино официальный сайт: пин ап зеркало – пинап казино
http://vavadavhod.tech/# vavada вход
vavada casino: vavada – vavada casino
пин ап вход пин ап вход пин ап вход
пин ап вход: пин ап зеркало – пин ап вход
https://pinuprus.pro/# пинап казино
вавада официальный сайт: вавада – vavada
pin up casino pin-up pin up
пин ап зеркало: пин ап вход – пин ап зеркало
http://pinuprus.pro/# пинап казино
вавада: вавада официальный сайт – вавада зеркало
вавада vavada casino вавада казино
pin up вход: pin up вход – pin up вход
http://vavadavhod.tech/# вавада официальный сайт
вавада зеркало: вавада зеркало – vavada вход
pin up azerbaycan: pinup az – pin up
pin up azerbaycan pin up pinup az
https://vavadavhod.tech/# вавада зеркало
вавада: вавада официальный сайт – vavada вход
пинап казино: pin up вход – пин ап казино
pin-up casino giris pin up pin-up casino giris
https://pinupaz.top/# pin-up
вавада казино: вавада официальный сайт – вавада
вавада казино: вавада официальный сайт – вавада зеркало
пин ап вход пин ап казино пинап казино
http://pinuprus.pro/# pin up вход
pin-up casino giris: pinup az – pin-up casino giris
вавада зеркало: vavada – вавада зеркало
https://pinupaz.top/# pin up
vavada vavada casino вавада зеркало
pin up casino: pinup az – pin-up
пин ап казино официальный сайт: пин ап зеркало – пин ап вход
http://vavadavhod.tech/# vavada вход
пинап казино пинап казино пин ап вход
vavada: вавада официальный сайт – вавада зеркало
пин ап зеркало: пин ап казино официальный сайт – пин ап казино официальный сайт
http://vavadavhod.tech/# вавада
pin up casino pin-up pinup az
вавада зеркало: vavada – вавада официальный сайт
пин ап казино официальный сайт: пин ап зеркало – pin up вход
https://pinupaz.top/# pin up
pin up az pin up az pin-up casino giris
pin up casino: pin up az – pinup az
https://pinuprus.pro/# пин ап вход
pin up: pin up az – pin up az
vavada casino вавада вавада
http://pinupaz.top/# pin-up
пин ап казино официальный сайт: pin up вход – пин ап вход
вавада официальный сайт: вавада зеркало – вавада зеркало
вавада зеркало вавада зеркало vavada вход
пин ап зеркало: пин ап казино – пин ап вход
vavada вход вавада казино vavada вход
https://pinupaz.top/# pin up
pin up вход: пин ап зеркало – пин ап зеркало
pin up вход: pin up вход – пин ап вход
pin up вход пин ап казино официальный сайт пин ап казино
http://pinuprus.pro/# пин ап вход
pin up azerbaycan: pin up az – pin up
вавада: vavada вход – vavada casino
pin up az pin up pin-up
https://pinupaz.top/# pinup az
pin up вход: пинап казино – pin up вход
вавада официальный сайт: вавада официальный сайт – вавада зеркало
pin up casino pin-up casino giris pinup az
http://pinupaz.top/# pin-up casino giris
pin up casino: pin-up casino giris – pin up casino
вавада официальный сайт: vavada вход – vavada casino
https://vavadavhod.tech/# vavada
вавада казино vavada casino вавада зеркало
вавада официальный сайт: вавада официальный сайт – vavada вход
vavada casino: вавада зеркало – вавада официальный сайт
http://vavadavhod.tech/# вавада казино
http://pinuprus.pro/# пинап казино
вавада официальный сайт: вавада официальный сайт – vavada casino
vavada: вавада – vavada вход
pin up azerbaycan pin up casino pin up azerbaycan
http://pinupaz.top/# pin up azerbaycan
вавада зеркало: вавада официальный сайт – vavada casino
vavada вавада зеркало вавада казино
пин ап зеркало: пин ап казино – пин ап казино
http://pinuprus.pro/# пин ап вход
вавада официальный сайт: vavada – vavada
пин ап зеркало: пинап казино – пин ап казино
vavada вавада зеркало вавада зеркало
pin up casino: pin up azerbaycan – pin up casino
https://vavadavhod.tech/# вавада зеркало
pin-up casino giris: pin-up casino giris – pin-up casino giris
vavada casino: вавада казино – vavada вход
вавада вавада казино vavada вход
https://pinupaz.top/# pin up casino
pin-up: pin up – pin up az
pinup az: pin up az – pin up az
пин ап вход pin up вход pin up вход
pinup az: pin up azerbaycan – pin-up casino giris
http://vavadavhod.tech/# вавада официальный сайт
пин ап вход: пин ап зеркало – pin up вход
вавада: вавада – vavada вход
pin-up casino giris pin up az pin up casino
пин ап зеркало: пин ап зеркало – пинап казино
http://pinupaz.top/# pin up az
pin-up: pin up – pin up az
пин ап казино: пин ап вход – pin up вход
pin up вход: pin up вход – пинап казино
pin up azerbaycan pin up azerbaycan pin up
https://vavadavhod.tech/# вавада зеркало
пин ап казино официальный сайт: пин ап казино – пин ап зеркало
vavada: vavada – вавада зеркало
пин ап вход: пинап казино – pin up вход
http://pinuprus.pro/# пин ап казино официальный сайт
вавада зеркало вавада зеркало vavada вход
pin-up: pin up – pin up casino
pinup az: pin up azerbaycan – pin up az
pin up casino: pin-up – pin up casino
http://vavadavhod.tech/# vavada вход
pin up: pinup az – pin up az
pin up az pin-up pin up azerbaycan
пин ап вход: пин ап зеркало – pin up вход
pin up azerbaycan: pin up az – pin up az
http://pinupaz.top/# pin up az
вавада: вавада – vavada вход
пин ап вход pin up вход пин ап зеркало
https://pinupaz.top/# pin-up
vavada: вавада – vavada casino
пин ап казино пин ап зеркало пин ап вход
пин ап зеркало: пин ап казино официальный сайт – пин ап казино
https://vavadavhod.tech/# вавада зеркало
pin-up: pin up casino – pin up azerbaycan
вавада зеркало вавада официальный сайт вавада официальный сайт
https://vavadavhod.tech/# вавада казино
вавада официальный сайт: vavada – vavada casino
пин ап казино пин ап казино официальный сайт pin up вход
http://pinupaz.top/# pin up az
пин ап казино официальный сайт: пин ап казино официальный сайт – пин ап вход
пин ап казино: пин ап вход – пин ап зеркало
пин ап казино пинап казино pin up вход
Medicine From India: indian pharmacy – medicine courier from India to USA
Medicine From India: indian pharmacy – medicine courier from India to USA
http://medicinefromindia.com/# indian pharmacy
real canadian pharmacy: canadian pharmacy – legit canadian pharmacy
mexican online pharmacy Rx Express Mexico mexico pharmacies prescription drugs
http://medicinefromindia.com/# Medicine From India
mexico pharmacy order online: mexico pharmacies prescription drugs – п»їbest mexican online pharmacies
Medicine From India: Medicine From India – Medicine From India
mexico pharmacies prescription drugs: mexican mail order pharmacies – mexican pharmaceuticals online
https://medicinefromindia.com/# medicine courier from India to USA
indian pharmacy online shopping: indian pharmacy online – medicine courier from India to USA
canada ed drugs Express Rx Canada canadian compounding pharmacy
thecanadianpharmacy: Express Rx Canada – certified canadian pharmacy
RxExpressMexico: RxExpressMexico – mexican online pharmacy
https://expressrxcanada.com/# escrow pharmacy canada
indian pharmacy: indian pharmacy online shopping – Medicine From India
mexican online pharmacy: mexican online pharmacy – mexican rx online
canada rx pharmacy Buy medicine from Canada reliable canadian online pharmacy
canadian online pharmacy reviews: Express Rx Canada – my canadian pharmacy reviews
medicine courier from India to USA: indian pharmacy online – medicine courier from India to USA
https://expressrxcanada.com/# canadadrugpharmacy com
canada pharmacy: Express Rx Canada – canada online pharmacy
mexico drug stores pharmacies mexican rx online mexican rx online
reliable canadian online pharmacy: Express Rx Canada – canadian pharmacy uk delivery
https://expressrxcanada.com/# the canadian pharmacy
cheap canadian pharmacy online: canadian pharmacy antibiotics – canadian family pharmacy
indian pharmacy: Medicine From India – medicine courier from India to USA
mexico drug stores pharmacies mexican rx online mexico pharmacy order online
best canadian online pharmacy reviews: ExpressRxCanada – best canadian pharmacy to order from
http://medicinefromindia.com/# medicine courier from India to USA
buy prescription drugs from canada cheap: Canadian pharmacy shipping to USA – my canadian pharmacy reviews
mexico pharmacies prescription drugs: mexico drug stores pharmacies – Rx Express Mexico
canadian pharmacy tampa canadian pharmacy canadian pharmacy
mexican rx online: mexican rx online – mexican rx online
http://medicinefromindia.com/# indian pharmacy
mexico drug stores pharmacies: buying prescription drugs in mexico online – Rx Express Mexico
indian pharmacy: indian pharmacy – Medicine From India
indian pharmacy online: indian pharmacy – indian pharmacy online shopping
mexican rx online Rx Express Mexico Rx Express Mexico
http://expressrxcanada.com/# canadian pharmacy review
Medicine From India: indian pharmacy online shopping – Medicine From India
canadian pharmacy victoza: ExpressRxCanada – canadian pharmacy no scripts
https://pharmafst.com/# acheter mГ©dicament en ligne sans ordonnance
Achetez vos kamagra medicaments: kamagra en ligne – Achetez vos kamagra medicaments
kamagra en ligne: Achetez vos kamagra medicaments – Kamagra Commander maintenant
kamagra livraison 24h: kamagra 100mg prix – kamagra oral jelly
Acheter Kamagra site fiable kamagra 100mg prix kamagra pas cher
https://kamagraprix.shop/# acheter kamagra site fiable
п»їpharmacie en ligne france: Medicaments en ligne livres en 24h – vente de mГ©dicament en ligne pharmafst.com
acheter mГ©dicament en ligne sans ordonnance: Livraison rapide – pharmacies en ligne certifiГ©es pharmafst.com
kamagra en ligne: Acheter Kamagra site fiable – Kamagra Commander maintenant
Achetez vos kamagra medicaments: Acheter Kamagra site fiable – kamagra en ligne
http://tadalmed.com/# cialis generique
Pharmacie sans ordonnance: pharmacie en ligne sans ordonnance – Pharmacie sans ordonnance pharmafst.com
pharmacie en ligne fiable: Medicaments en ligne livres en 24h – pharmacie en ligne livraison europe pharmafst.com
https://pharmafst.com/# pharmacie en ligne sans ordonnance
pharmacie en ligne pas cher: Meilleure pharmacie en ligne – п»їpharmacie en ligne france pharmafst.com
https://pharmafst.com/# pharmacie en ligne france livraison belgique
Cialis generique prix: Acheter Viagra Cialis sans ordonnance – Acheter Viagra Cialis sans ordonnance tadalmed.shop
https://tadalmed.com/# cialis sans ordonnance
Pharmacie Internationale en ligne: vente de mГ©dicament en ligne – pharmacies en ligne certifiГ©es pharmafst.com
Acheter Viagra Cialis sans ordonnance Acheter Cialis 20 mg pas cher Cialis generique prix tadalmed.com
http://pharmafst.com/# pharmacie en ligne sans ordonnance
trouver un mГ©dicament en pharmacie: Medicaments en ligne livres en 24h – Pharmacie sans ordonnance pharmafst.com
acheter kamagra site fiable: Kamagra pharmacie en ligne – kamagra gel
Acheter Cialis 20 mg pas cher: Tadalafil achat en ligne – Tadalafil 20 mg prix sans ordonnance tadalmed.shop
Tadalafil achat en ligne Cialis sans ordonnance pas cher Cialis sans ordonnance 24h tadalmed.com
Kamagra Commander maintenant: Kamagra pharmacie en ligne – acheter kamagra site fiable
http://tadalmed.com/# Tadalafil sans ordonnance en ligne
Cialis sans ordonnance 24h: Cialis en ligne – Tadalafil 20 mg prix sans ordonnance tadalmed.shop
kamagra 100mg prix: acheter kamagra site fiable – achat kamagra
Pharmacie en ligne Cialis sans ordonnance: Achat Cialis en ligne fiable – cialis prix tadalmed.shop
https://pharmafst.com/# pharmacie en ligne avec ordonnance
kamagra gel kamagra oral jelly kamagra gel
Acheter Kamagra site fiable: kamagra oral jelly – Kamagra pharmacie en ligne
pharmacie en ligne sans ordonnance: pharmacie en ligne – trouver un mГ©dicament en pharmacie pharmafst.com
pharmacie en ligne france pas cher: pharmacie en ligne pas cher – pharmacie en ligne avec ordonnance pharmafst.com
https://kamagraprix.shop/# kamagra 100mg prix
Kamagra Oral Jelly pas cher achat kamagra Kamagra Oral Jelly pas cher
Kamagra Commander maintenant: acheter kamagra site fiable – kamagra pas cher
Kamagra Oral Jelly pas cher: achat kamagra – acheter kamagra site fiable
http://kamagraprix.com/# Achetez vos kamagra medicaments
Achetez vos kamagra medicaments acheter kamagra site fiable Kamagra Commander maintenant
kamagra oral jelly: kamagra gel – Kamagra Commander maintenant
Cialis en ligne: cialis sans ordonnance – Acheter Cialis tadalmed.shop
п»їpharmacie en ligne france: pharmacie en ligne sans ordonnance – Pharmacie Internationale en ligne pharmafst.com
http://tadalmed.com/# Cialis sans ordonnance 24h
Acheter Kamagra site fiable: kamagra 100mg prix – Acheter Kamagra site fiable
Tadalafil sans ordonnance en ligne cialis sans ordonnance Tadalafil 20 mg prix sans ordonnance tadalmed.com
Cialis sans ordonnance 24h: Achat Cialis en ligne fiable – Cialis en ligne tadalmed.shop
Tadalafil 20 mg prix en pharmacie: Cialis sans ordonnance 24h – Tadalafil 20 mg prix sans ordonnance tadalmed.shop
Acheter Viagra Cialis sans ordonnance: Cialis en ligne – Acheter Cialis tadalmed.shop
https://kamagraprix.shop/# Kamagra pharmacie en ligne
Kamagra Oral Jelly pas cher: kamagra oral jelly – kamagra gel
pharmacie en ligne france livraison belgique: Meilleure pharmacie en ligne – pharmacie en ligne sans ordonnance pharmafst.com
kamagra gel Kamagra pharmacie en ligne kamagra en ligne
pharmacie en ligne france livraison belgique: Pharmacie en ligne France – pharmacie en ligne sans ordonnance pharmafst.com
https://pharmafst.shop/# pharmacie en ligne france pas cher
Cialis sans ordonnance 24h: Cialis sans ordonnance 24h – cialis prix tadalmed.shop
achat kamagra: Kamagra Commander maintenant – kamagra 100mg prix
pharmacie en ligne france fiable pharmacie en ligne fiable pharmacie en ligne sans ordonnance pharmafst.shop
https://tadalmed.shop/# Acheter Cialis 20 mg pas cher
vente de mГ©dicament en ligne: Livraison rapide – pharmacie en ligne livraison europe pharmafst.com
achat kamagra: Kamagra Commander maintenant – achat kamagra
Pharmacie en ligne Cialis sans ordonnance: Cialis en ligne – Tadalafil achat en ligne tadalmed.shop
Achetez vos kamagra medicaments: kamagra 100mg prix – Kamagra pharmacie en ligne
kamagra en ligne kamagra en ligne Acheter Kamagra site fiable
Tadalafil sans ordonnance en ligne: cialis generique – Tadalafil 20 mg prix en pharmacie tadalmed.shop
kamagra pas cher: kamagra pas cher – kamagra en ligne
pharmacie en ligne avec ordonnance: pharmacie en ligne – pharmacie en ligne france pas cher pharmafst.com
pharmacie en ligne fiable pharmacie en ligne sans ordonnance pharmacie en ligne france livraison internationale pharmafst.shop
kamagra en ligne: kamagra gel – Kamagra Oral Jelly pas cher
pharmacie en ligne sans ordonnance: Meilleure pharmacie en ligne – Pharmacie Internationale en ligne pharmafst.com
pharmacie en ligne livraison europe Pharmacies en ligne certifiees vente de mГ©dicament en ligne pharmafst.shop
acheter kamagra site fiable: kamagra pas cher – Kamagra Commander maintenant
pharmacies en ligne certifiГ©es acheter mГ©dicament en ligne sans ordonnance Pharmacie sans ordonnance pharmafst.shop
pharmacie en ligne france pas cher: Meilleure pharmacie en ligne – pharmacie en ligne avec ordonnance pharmafst.com
Cialis generique prix cialis generique Cialis generique prix tadalmed.com
kamagra oral jelly: achat kamagra – kamagra 100mg prix
olympe casino cresus: olympe casino avis – casino olympe
olympe casino: casino olympe – olympe
olympe casino cresus olympe casino
olympe casino en ligne olympe casino cresus
olympe casino cresus: olympe – olympe
olympe casino en ligne: olympe – olympe casino avis
casino olympe casino olympe
olympe casino en ligne: olympe casino cresus – casino olympe
olympe casino en ligne olympe casino cresus
casino olympe: olympe casino en ligne – casino olympe
olympe casino en ligne: olympe casino avis – casino olympe
olympe olympe casino en ligne
olympe casino cresus: olympe casino cresus – olympe
olympe casino cresus casino olympe
olympe casino en ligne: olympe casino en ligne – olympe casino en ligne
casino olympe casino olympe
olympe casino cresus: olympe casino cresus – casino olympe
https://olympecasino.pro/# casino olympe
olympe: olympe casino en ligne – olympe casino en ligne
olympe casino cresus olympe casino en ligne
olympe casino cresus: olympe casino – olympe casino avis
olympe casino en ligne: olympe casino – olympe casino
casino olympe: olympe casino – casino olympe
olympe casino avis olympe casino avis
casino olympe: olympe casino – olympe
casino olympe: casino olympe – olympe
olympe casino en ligne: olympe casino en ligne – olympe casino cresus
casino olympe olympe casino cresus
olympe casino cresus: olympe casino cresus – olympe casino
olympe casino avis: casino olympe – olympe casino en ligne
olympe casino avis: olympe casino avis – olympe casino en ligne
https://olympecasino.pro/# olympe casino cresus
olympe olympe casino cresus
olympe casino avis: olympe casino – olympe casino en ligne
olympe casino cresus: olympe – olympe casino avis
casino olympe olympe
olympe casino cresus: casino olympe – olympe casino avis
olympe: olympe casino cresus – olympe casino cresus
olympe casino avis: olympe casino cresus – casino olympe
olympe: casino olympe – casino olympe
olympe olympe casino
casino olympe: casino olympe – olympe
olympe casino en ligne: casino olympe – olympe casino avis
olympe olympe casino cresus
olympe casino: olympe casino – olympe casino
olympe: casino olympe – olympe casino cresus
olympe: olympe – olympe
olympe: olympe casino – olympe casino cresus
olympe: olympe – olympe casino avis
olympe casino olympe casino cresus
olympe casino en ligne: olympe casino – olympe casino cresus
olympe casino: olympe casino cresus – olympe casino avis
olympe casino cresus olympe casino avis
olympe casino avis: olympe – olympe
olympe casino cresus: olympe casino en ligne – olympe casino en ligne
usa canada pharm: canadapharmacyonline – canadian pharmacy india
online pharmacy canada canada pharmacy reviews USACanadaPharm
northern pharmacy canada: USACanadaPharm – usa canada pharm
https://usacanadapharm.com/# USACanadaPharm
www canadianonlinepharmacy: canadian pharmacy service – canada pharmacy online legit
prescription drugs canada buy online: usa canada pharm – USACanadaPharm
https://usacanadapharm.com/# canadian pharmacy ltd
online canadian drugstore USACanadaPharm canadian world pharmacy
the canadian pharmacy: usa canada pharm – USACanadaPharm
canadian pharmacy 1 internet online drugstore: usa canada pharm – pharmacy in canada
http://usacanadapharm.com/# pet meds without vet prescription canada
canadian drugstore online: real canadian pharmacy – reputable canadian online pharmacy
canadian pharmacy com http://usacanadapharm.com/# USACanadaPharm
drugs from canada
USACanadaPharm: canada drugs – usa canada pharm
canadianpharmacymeds com USACanadaPharm usa canada pharm
https://usacanadapharm.com/# canadian pharmacy 24h com
canadian mail order pharmacy: USACanadaPharm – canadian pharmacy 1 internet online drugstore
USACanadaPharm: usa canada pharm – canadian pharmacy online
http://usacanadapharm.com/# canadian pharmacy online reviews
recommended canadian pharmacies: USACanadaPharm – canadian pharmacy 24 com
USACanadaPharm canadian pharmacy review canadian pharmacy world
canadian pharmacy online store: canadian drugs online – USACanadaPharm
http://usacanadapharm.com/# legitimate canadian pharmacy online
usa canada pharm: USACanadaPharm – USACanadaPharm
USACanadaPharm: usa canada pharm – canadapharmacyonline
reddit canadian pharmacy: canadian pharmacy india – usa canada pharm
http://usacanadapharm.com/# USACanadaPharm
best canadian pharmacy online: USACanadaPharm – usa canada pharm
global pharmacy canada usa canada pharm usa canada pharm
canadian pharmacy price checker: canadian pharmacy – usa canada pharm
USACanadaPharm: usa canada pharm – online canadian pharmacy reviews
https://usacanadapharm.com/# best canadian pharmacy to order from
USACanadaPharm: reliable canadian pharmacy – onlinepharmaciescanada com
USACanadaPharm: usa canada pharm – USACanadaPharm
legit canadian pharmacy online usa canada pharm best online canadian pharmacy
USACanadaPharm: canadian pharmacy meds review – usa canada pharm
http://usacanadapharm.com/# canadian pharmacy online reviews
www canadianonlinepharmacy: canada cloud pharmacy – USACanadaPharm
reputable canadian online pharmacy: usa canada pharm – global pharmacy canada
https://usacanadapharm.shop/# usa canada pharm
online canadian pharmacy reviews canadian pharmacy ed medications canadian pharmacy drugs online
canadapharmacyonline legit: cheap canadian pharmacy online – canada drugs
india online pharmacy: Online medicine order – online pharmacy india
http://usaindiapharm.com/# online pharmacy india
best india pharmacy: reputable indian pharmacies – indian pharmacy
USA India Pharm: india pharmacy mail order – UsaIndiaPharm
mail order pharmacy india: world pharmacy india – USA India Pharm
UsaIndiaPharm indian pharmacy paypal top 10 pharmacies in india
https://usaindiapharm.com/# Online medicine order
USA India Pharm: indian pharmacy paypal – USA India Pharm
online pharmacy india: indian pharmacy paypal – USA India Pharm
USA India Pharm: indianpharmacy com – mail order pharmacy india
http://usaindiapharm.com/# UsaIndiaPharm
UsaIndiaPharm UsaIndiaPharm pharmacy website india
Online medicine order: UsaIndiaPharm – buy prescription drugs from india
USA India Pharm: pharmacy website india – indianpharmacy com
UsaIndiaPharm: best online pharmacy india – india pharmacy
https://usaindiapharm.com/# USA India Pharm
USA India Pharm: UsaIndiaPharm – india pharmacy
top 10 pharmacies in india: UsaIndiaPharm – india online pharmacy
п»їlegitimate online pharmacies india: USA India Pharm – UsaIndiaPharm
https://usaindiapharm.com/# UsaIndiaPharm
Online medicine home delivery online pharmacy india UsaIndiaPharm
UsaIndiaPharm: top online pharmacy india – Online medicine order
UsaIndiaPharm: UsaIndiaPharm – USA India Pharm
UsaIndiaPharm: pharmacy website india – india pharmacy mail order
online shopping pharmacy india: reputable indian online pharmacy – world pharmacy india
https://usaindiapharm.shop/# USA India Pharm
USA India Pharm: UsaIndiaPharm – п»їlegitimate online pharmacies india
world pharmacy india reputable indian pharmacies UsaIndiaPharm
cheapest online pharmacy india: best online pharmacy india – USA India Pharm
http://usaindiapharm.com/# п»їlegitimate online pharmacies india
top 10 online pharmacy in india: UsaIndiaPharm – online shopping pharmacy india
Online medicine order: best online pharmacy india – cheapest online pharmacy india
https://usaindiapharm.com/# top online pharmacy india
USA India Pharm: india pharmacy mail order – top 10 pharmacies in india
USA India Pharm: Online medicine order – online shopping pharmacy india
USA India Pharm best india pharmacy world pharmacy india
india online pharmacy: UsaIndiaPharm – USA India Pharm
https://usaindiapharm.com/# indian pharmacy online
india pharmacy: cheapest online pharmacy india – mail order pharmacy india
USA India Pharm: USA India Pharm – world pharmacy india
best online pharmacy india: USA India Pharm – online shopping pharmacy india
UsaIndiaPharm: india online pharmacy – UsaIndiaPharm
http://usaindiapharm.com/# online pharmacy india
USA India Pharm USA India Pharm Online medicine home delivery
USA India Pharm: indian pharmacy paypal – USA India Pharm
USA India Pharm: UsaIndiaPharm – USA India Pharm
UsaIndiaPharm: best india pharmacy – indian pharmacy paypal
https://usaindiapharm.com/# mail order pharmacy india
UsaIndiaPharm: UsaIndiaPharm – best india pharmacy
USA India Pharm: USA India Pharm – UsaIndiaPharm
india online pharmacy: indian pharmacies safe – UsaIndiaPharm
indianpharmacy com UsaIndiaPharm UsaIndiaPharm
https://usmexpharm.shop/# UsMex Pharm
usa mexico pharmacy: Mexican pharmacy ship to USA – certified Mexican pharmacy
USMexPharm: UsMex Pharm – Mexican pharmacy ship to USA
usa mexico pharmacy: mexican border pharmacies shipping to usa – USMexPharm
https://usmexpharm.shop/# certified Mexican pharmacy
Mexican pharmacy ship to USA: UsMex Pharm – Mexican pharmacy ship to USA
mexican pharmacy pharmacies in mexico that ship to usa usa mexico pharmacy
mexican pharmacy: certified Mexican pharmacy – Mexican pharmacy ship to USA
certified Mexican pharmacy: UsMex Pharm – usa mexico pharmacy
Mexican pharmacy ship to USA: usa mexico pharmacy – Mexican pharmacy ship to USA
https://usmexpharm.com/# usa mexico pharmacy
pharmacies in mexico that ship to usa: Us Mex Pharm – mexico pharmacies prescription drugs
UsMex Pharm: mexican rx online – UsMex Pharm
Mexican pharmacy ship to USA: Mexican pharmacy ship to USA – USMexPharm
mexican pharmacy usa mexico pharmacy USMexPharm
http://usmexpharm.com/# UsMex Pharm
mexican pharmacy: Us Mex Pharm – certified Mexican pharmacy
UsMex Pharm: Us Mex Pharm – usa mexico pharmacy
UsMex Pharm: mexican pharmacy – USMexPharm
https://usmexpharm.shop/# UsMex Pharm
UsMex Pharm: mexican border pharmacies shipping to usa – mexican pharmacy
Mexican pharmacy ship to USA: UsMex Pharm – UsMex Pharm
Mexican pharmacy ship to USA mexican pharmacy UsMex Pharm
Us Mex Pharm: mexican pharmacy – Mexican pharmacy ship to USA
http://usmexpharm.com/# mexican rx online
mexican pharmacy: Mexican pharmacy ship to USA – USMexPharm
usa mexico pharmacy: certified Mexican pharmacy – mexican mail order pharmacies
Us Mex Pharm: mexican pharmaceuticals online – UsMex Pharm
Us Mex Pharm: Mexican pharmacy ship to USA – USMexPharm
https://usmexpharm.com/# USMexPharm
medicine in mexico pharmacies Us Mex Pharm reputable mexican pharmacies online
mexican pharmacy: usa mexico pharmacy – Us Mex Pharm
Mexican pharmacy ship to USA: Us Mex Pharm – usa mexico pharmacy
Mexican pharmacy ship to USA: UsMex Pharm – usa mexico pharmacy
https://usmexpharm.com/# mexican online pharmacies prescription drugs
en gГјvenilir bahis siteleri: casibom resmi – 300 tl bonus veren bahis sitesi casibom1st.com
sweet bonanza siteleri: sweet bonanza oyna – sweet bonanza demo sweetbonanza1st.shop
deneme bonusu veren yeni casino siteleri casibom mobil giris betboo plus casibom1st.shop
en iyi bahis sitesi hangisi: casino siteleri – slot casino siteleri casinositeleri1st.com
guvenilir casino siteleri: casino siteleri 2025 – guvenilir casino siteleri casinositeleri1st.com
http://sweetbonanza1st.com/# sweet bonanza yorumlar
canlД± oyunlar: deneme bonusu veren siteler – slot casino siteleri casinositeleri1st.com
casino turkey: casibom mobil giris – yeni deneme bonusu veren siteler 2025 casibom1st.com
sweet bonanza demo sweet bonanza oyna sweet bonanza 1st sweetbonanza1st.com
casino siteleri 2024: casibom mobil giris – deneme bonusu veren gГјvenilir siteler casibom1st.com
sweet bonanza slot: sweet bonanza demo – sweet bonanza siteleri sweetbonanza1st.shop
sweet bonanza siteleri: sweet bonanza oyna – sweet bonanza siteleri sweetbonanza1st.shop
sweet bonanza demo: sweet bonanza siteleri – sweet bonanza demo sweetbonanza1st.shop
canlД± casino bonusu veren siteler: guvenilir casino siteleri – slot casino siteleri casinositeleri1st.com
https://sweetbonanza1st.shop/# sweet bonanza yorumlar
sweet bonanza 1st sweet bonanza slot sweet bonanza slot sweetbonanza1st.com
en gГјvenilir bahis: slot casino siteleri – casino siteleri 2025 casinositeleri1st.com
sweet bonanza siteleri: sweet bonanza – sweet bonanza demo sweetbonanza1st.shop
casino siteleri 2025: lisansl? casino siteleri – yabancД± Еџans oyunlarД± siteleri casinositeleri1st.com
sweet bonanza yorumlar: sweet bonanza demo – sweet bonanza siteleri sweetbonanza1st.shop
yurtdД±ЕџД± bahis siteleri casibom guncel adres bahis siteleri deneme bonusu veren casibom1st.shop
yeni siteler bahis: en iyi oyun siteleri – yabancД± Еџans oyunlarД± siteleri casinositeleri1st.com
bahis siyeleri: casibom – casino bonanza gГјncel giriЕџ casibom1st.com
sweet bonanza 1st: sweet bonanza yorumlar – sweet bonanza demo sweetbonanza1st.shop
sweet bonanza: sweet bonanza demo – sweet bonanza demo sweetbonanza1st.shop
sweet bonanza sweet bonanza giris sweet bonanza giris sweetbonanza1st.com
sweet bonanza demo: sweet bonanza – sweet bonanza sweetbonanza1st.shop
slot casino siteleri: casino bet giriЕџ – casino siteleri casinositeleri1st.com
casino maxi: casibom giris adresi – vaycasino casibom1st.com
canlД± casino oyna: casibom mobil giris – yasal kumar siteleri casibom1st.com
sweet bonanza oyna: sweet bonanza demo – sweet bonanza slot sweetbonanza1st.shop
internet kumar siteleri: slot casino siteleri – casino siteleri 2025 casinositeleri1st.com
deneme bonus siteler casibom tГјrk partner siteleri casibom1st.shop
https://casibom1st.shop/# en iyi bahis sitesi hangisi
sweet bonanza siteleri: sweet bonanza 1st – sweet bonanza oyna sweetbonanza1st.shop
en iyi deneme bonusu veren siteler: casibom mobil giris – bahis siteleri isimleri casibom1st.com
sweet bonanza demo: sweet bonanza slot – sweet bonanza 1st sweetbonanza1st.shop
casino siteleri: deneme bonusu veren siteler – lisansl? casino siteleri casinositeleri1st.com
https://casinositeleri1st.com/# casino siteleri 2025
guvenilir casino siteleri: lisansl? casino siteleri – casino siteleri 2025 casinositeleri1st.com
AmOnlinePharm where can you buy amoxicillin over the counter AmOnlinePharm
amoxicillin 500 mg for sale: AmOnlinePharm – AmOnlinePharm
AmOnlinePharm: AmOnlinePharm – buy amoxicillin 500mg capsules uk
http://amonlinepharm.com/# buy amoxicillin online without prescription
zithromax without prescription: ZithPharmOnline – zithromax online no prescription
ZithPharmOnline: zithromax buy online – ZithPharmOnline
Lisin Express: online lisinopril – where to buy lisinopril without prescription
Lisin Express zestril 25 mg Lisin Express
http://zithpharmonline.com/# zithromax online
amoxicillin online purchase: where to buy amoxicillin over the counter – amoxicillin 500mg over the counter
Clom Fast Pharm: Clom Fast Pharm – how can i get cheap clomid
ZithPharmOnline: zithromax buy – ZithPharmOnline
where can i get amoxicillin 500 mg: AmOnlinePharm – AmOnlinePharm
https://zithpharmonline.shop/# ZithPharmOnline
prednisone 20 mg purchase: price of prednisone tablets – prednisone 20mg for sale
Lisin Express: Lisin Express – price for 5 mg lisinopril
how to buy cheap clomid prices Clom Fast Pharm can you buy cheap clomid now
Pred Pharm Net: Pred Pharm Net – Pred Pharm Net
http://lisinexpress.com/# lisinopril 2.5 mg tablet
price of amoxicillin without insurance: AmOnlinePharm – AmOnlinePharm
lisinopril cost 5mg: lisinopril 40 mg no prescription – Lisin Express
5 prednisone in mexico: Pred Pharm Net – Pred Pharm Net
https://zithpharmonline.com/# ZithPharmOnline
AmOnlinePharm: amoxicillin 500mg capsule cost – amoxicillin from canada
amoxicillin 500mg capsules price AmOnlinePharm AmOnlinePharm
where can i get zithromax: ZithPharmOnline – where can i buy zithromax capsules
Pred Pharm Net: Pred Pharm Net – buy generic prednisone online
how to get zithromax online: generic zithromax india – zithromax 600 mg tablets
http://lisinexpress.com/# Lisin Express
zithromax 250 mg tablet price: zithromax 500 mg for sale – ZithPharmOnline
Pred Pharm Net: prednisone 20 mg prices – prednisone 10mg for sale
where to buy clomid online: Clom Fast Pharm – Clom Fast Pharm
amoxicillin without a prescription buy amoxicillin 500mg uk AmOnlinePharm
http://amonlinepharm.com/# amoxicillin pharmacy price
Pred Pharm Net: purchase prednisone 10mg – Pred Pharm Net
AmOnlinePharm: order amoxicillin 500mg – AmOnlinePharm
lisinopril 25: buy generic lisinopril – zestril 5 mg tablet
https://predpharmnet.shop/# Pred Pharm Net
zithromax buy online no prescription: ZithPharmOnline – ZithPharmOnline
Clom Fast Pharm can i purchase cheap clomid without rx where to buy clomid without dr prescription
can i get cheap clomid now: Clom Fast Pharm – where to buy generic clomid for sale
zithromax 500 tablet: can i buy zithromax online – zithromax prescription in canada
medicine prednisone 10mg: Pred Pharm Net – Pred Pharm Net
http://amonlinepharm.com/# AmOnlinePharm
can you buy amoxicillin over the counter: price of amoxicillin without insurance – AmOnlinePharm
Pred Pharm Net: Pred Pharm Net – prednisone cost us
Pred Pharm Net: Pred Pharm Net – canine prednisone 5mg no prescription
http://lisinexpress.com/# Lisin Express
ZithPharmOnline ZithPharmOnline zithromax 500mg
Clom Fast Pharm: can i order cheap clomid without a prescription – can i order generic clomid tablets
indian pharmacies safe: top online pharmacy india – indian pharmacies safe
top 10 pharmacies in india: www india pharm – indian pharmacies safe
Agb Mexico Pharm: best online pharmacies in mexico – Agb Mexico Pharm
indian pharmacy indianpharmacy com www india pharm
Agb Mexico Pharm: Agb Mexico Pharm – Agb Mexico Pharm
canada pharmacy world: GoCanadaPharm – canadian online pharmacy reviews
top 10 online pharmacy in india: reputable indian online pharmacy – cheapest online pharmacy india
https://agbmexicopharm.shop/# Agb Mexico Pharm
mexican rx online: Agb Mexico Pharm – purple pharmacy mexico price list
Agb Mexico Pharm: mexican rx online – reputable mexican pharmacies online
Online medicine order online shopping pharmacy india www india pharm
http://gocanadapharm.com/# canada drugs
canada drugs online reviews: GoCanadaPharm – reliable canadian online pharmacy
canada pharmacy 24h: legitimate canadian pharmacies – canada drug pharmacy
canadian online drugs: canadian drug – canadian pharmacy ratings
mexican mail order pharmacies: Agb Mexico Pharm – pharmacies in mexico that ship to usa
https://agbmexicopharm.com/# mexico drug stores pharmacies
canadian pharmacies comparison go canada pharm canada drugs reviews
india pharmacy mail order: india pharmacy mail order – india pharmacy mail order
Agb Mexico Pharm: Agb Mexico Pharm – medicine in mexico pharmacies
www india pharm: indian pharmacies safe – www india pharm
https://gocanadapharm.com/# canadapharmacyonline legit
п»їbest mexican online pharmacies: Agb Mexico Pharm – mexican border pharmacies shipping to usa
best online pharmacies in mexico: Agb Mexico Pharm – Agb Mexico Pharm
Agb Mexico Pharm: Agb Mexico Pharm – Agb Mexico Pharm
onlinecanadianpharmacy: canadian online pharmacy – reputable canadian online pharmacy
http://agbmexicopharm.com/# mexico drug stores pharmacies
Agb Mexico Pharm best online pharmacies in mexico Agb Mexico Pharm
my canadian pharmacy rx: go canada pharm – best canadian pharmacy
buy prescription drugs from india: www india pharm – indian pharmacies safe
www india pharm: www india pharm – indianpharmacy com
http://agbmexicopharm.com/# Agb Mexico Pharm
vipps canadian pharmacy: go canada pharm – canadian pharmacy near me
mexico drug stores pharmacies: Agb Mexico Pharm – Agb Mexico Pharm
canadian pharmacy victoza canadian pharmacy 1 internet online drugstore canadian pharmacy mall
www india pharm: top 10 online pharmacy in india – indianpharmacy com
https://gocanadapharm.com/# canadian drugs online
www canadianonlinepharmacy: GoCanadaPharm – online canadian pharmacy review
medicine in mexico pharmacies: mexican mail order pharmacies – mexico pharmacies prescription drugs
Agb Mexico Pharm: Agb Mexico Pharm – Agb Mexico Pharm
https://gocanadapharm.com/# canadian pharmacy meds reviews
safe online pharmacies in canada: canada discount pharmacy – canadian pharmacy world reviews
buy medicines online in india mail order pharmacy india www india pharm
Online apotheek Nederland zonder recept: Online apotheek Nederland met recept – Online apotheek Nederland zonder recept
https://kamagrapotenzmittel.com/# Kamagra Gel
Les acides aminés essentiels jouent un rôle fondamental dans le bon fonctionnement du corps. Que ce soit pour la réparation musculaire, la production d’hormones ou le bon équilibre du métabolisme, leur apport ne doit pas être négligé. L’alimentation est la principale source de ces nutriments, mais dans certains cas, une supplémentation peut s’avérer utile, notamment pour les sportifs ou les personnes ayant des besoins spécifiques. En cherchant des informations sur l’importance de ces nutriments, je suis tombé sur ce site qui propose aussi des conseils pratiques sur divers sujets. J’y ai découvert comment télécharger l’application Melbet en Côte d’Ivoire https://melbet-ivory-coast.com/ , ce qui peut être intéressant pour ceux qui veulent explorer cette option. Comprendre l’impact des acides aminés permet d’adapter son alimentation et d’améliorer son bien-être au quotidien.
Apotheek Max: Apotheek Max – de online drogist kortingscode
http://apotheekmax.com/# Apotheek online bestellen
https://kamagrapotenzmittel.com/# Kamagra Original
online apotheek: online apotheek – Online apotheek Nederland met recept
apotek pa nett apotek online Apotek hemleverans recept
de online drogist kortingscode: Apotheek Max – Apotheek online bestellen
https://kamagrapotenzmittel.com/# Kamagra kaufen
apotek pa nett: Apoteket online – apotek online
https://kamagrapotenzmittel.shop/# kamagra
Kamagra Original: Kamagra Original – Kamagra Oral Jelly
https://kamagrapotenzmittel.com/# Kamagra kaufen ohne Rezept
online apotheek Apotheek online bestellen Beste online drogist
Apotek hemleverans recept: apotek online recept – Apotek hemleverans recept
https://apotheekmax.com/# Apotheek online bestellen
apotek online recept: apotek online recept – apotek online
http://kamagrapotenzmittel.com/# Kamagra Original
http://kamagrapotenzmittel.com/# Kamagra Oral Jelly
Online apotheek Nederland met recept: Online apotheek Nederland met recept – online apotheek
online apotheek Betrouwbare online apotheek zonder recept Beste online drogist
apotek pa nett: Apoteket online – Apotek hemleverans recept
https://apotekonlinerecept.com/# Apoteket online
https://apotheekmax.com/# online apotheek
Apotek hemleverans recept: Apoteket online – apotek online
https://apotheekmax.com/# online apotheek
apotek pa nett: apotek online – apotek online recept
Kamagra kaufen ohne Rezept: Kamagra online bestellen – Kamagra Original
http://kamagrapotenzmittel.com/# Kamagra Gel
online apotheek Online apotheek Nederland zonder recept Apotheek Max
https://apotekonlinerecept.shop/# apotek online
Online apotheek Nederland met recept: Betrouwbare online apotheek zonder recept – Online apotheek Nederland zonder recept
Apotheek online bestellen: Apotheek Max – Beste online drogist
https://kamagrapotenzmittel.shop/# Kamagra Original
https://apotheekmax.com/# Apotheek online bestellen
Kamagra Oral Jelly: Kamagra Oral Jelly kaufen – Kamagra Gel
http://kamagrapotenzmittel.com/# Kamagra Original
Kamagra Gel Kamagra online bestellen Kamagra Gel
Online apotheek Nederland met recept: Online apotheek Nederland met recept – online apotheek
http://apotheekmax.com/# ApotheekMax
http://kamagrapotenzmittel.com/# Kamagra kaufen ohne Rezept
de online drogist kortingscode: Betrouwbare online apotheek zonder recept – Apotheek online bestellen
Kamagra Gel: Kamagra kaufen ohne Rezept – Kamagra Oral Jelly
https://kamagrapotenzmittel.com/# kamagra
apotek pa nett apotek online Apoteket online
http://apotheekmax.com/# Online apotheek Nederland met recept
Kamagra Oral Jelly: Kamagra Original – Kamagra Original
Betrouwbare online apotheek zonder recept: Beste online drogist – Apotheek online bestellen
https://apotheekmax.shop/# Online apotheek Nederland zonder recept
http://apotekonlinerecept.com/# Apotek hemleverans idag
Apotheek online bestellen: Betrouwbare online apotheek zonder recept – Online apotheek Nederland met recept
Online apotheek Nederland zonder recept: Online apotheek Nederland met recept – Online apotheek Nederland met recept
kamagra Kamagra Gel Kamagra Original
Les paris sportifs, ça peut vraiment être excitant, mais il faut savoir où on met les pieds. J’ai vite compris qu’il ne suffit pas de choisir un site au hasard. Sur https://betwinner-de-cote-divoire.com/ j’ai trouvé des infos claires sur l’inscription et les bonus, ce qui m’a bien aidé. Ce qui est essentiel, c’est de choisir une plateforme fiable, avec des paiements rapides et un bon service client. Et surtout, il faut garder la tête froide, ne jamais parier sur un coup de tête et surtout bien gérer son budget. C’est une question de stratégie, pas de chance.
пин ап казино зеркало – пин ап казино зеркало
пин ап зеркало – пин ап
пин ап: https://pinupkz.life/
TadalafilEasyBuy.com Tadalafil Easy Buy cialis without a doctor prescription
пин ап казино официальный сайт – pinup 2025
пин ап – пин ап зеркало
пин ап казино официальный сайт: https://pinupkz.life/
пин ап казино – пинап казино
пинап казино – пин ап казино официальный сайт
пинап казино: https://pinupkz.life/
kamagra 100mg kopen Kamagra Kopen Online Kamagra Kopen
pinup 2025 – пин ап казино
pinup 2025 – пин ап зеркало
pinup 2025: https://pinupkz.life/
пин ап – пин ап
пин ап вход – пинап казино
cheap viagra viagra without prescription Viagra tablet online
pinup 2025: https://pinupkz.life/
пинап казино – пин ап казино зеркало
пин ап вход – пин ап казино
пин ап казино официальный сайт: https://pinupkz.life/
pinup 2025 – пин ап казино зеркало
pinup 2025 – пин ап
пин ап вход: https://pinupkz.life/
cialis without a doctor prescription Tadalafil Easy Buy Generic Cialis without a doctor prescription
pinup 2025 – pinup 2025
пин ап казино зеркало – pinup 2025
kamagra jelly kopen: Kamagra Kopen – Kamagra
Kamagra Kopen Online: Kamagra Kopen – Kamagra Kopen
https://tadalafileasybuy.shop/# Cialis 20mg price
https://kamagrakopen.pro/# Kamagra Kopen
Generic100mgEasy: Cheap generic Viagra online – buy generic 100mg viagra online
Generic100mgEasy buy generic 100mg viagra online buy generic 100mg viagra online
Officiele Kamagra van Nederland: KamagraKopen.pro – kamagra pillen kopen
https://generic100mgeasy.shop/# Order Viagra 50 mg online
http://generic100mgeasy.com/# buy generic 100mg viagra online
Kamagra: kamagra kopen nederland – kamagra 100mg kopen
https://kamagrakopen.pro/# KamagraKopen.pro
https://generic100mgeasy.shop/# viagra canada
cialis without a doctor prescription: Generic Cialis without a doctor prescription – TadalafilEasyBuy.com
Kamagra Kopen kamagra kopen nederland kamagra 100mg kopen
http://generic100mgeasy.com/# Cheap generic Viagra online
https://generic100mgeasy.com/# buy generic 100mg viagra online
Kamagra Kopen: kamagra pillen kopen – kamagra kopen nederland
Generic100mgEasy: Generic100mgEasy – buy generic 100mg viagra online
kamagra jelly kopen: kamagra gel kopen – kamagra jelly kopen
http://generic100mgeasy.com/# Cheapest Sildenafil online
https://generic100mgeasy.shop/# generic sildenafil
kamagra kopen nederland: kamagra pillen kopen – kamagra kopen nederland
Buy generic 100mg Viagra online Generic 100mg Easy Viagra generic over the counter
buy generic 100mg viagra online: Generic 100mg Easy – Generic Viagra online
https://kamagrakopen.pro/# Kamagra Kopen
https://generic100mgeasy.shop/# Buy Viagra online cheap
buy generic 100mg viagra online: buy generic 100mg viagra online – buy generic 100mg viagra online
Kamagra Kopen Online: kamagra 100mg kopen – Kamagra
https://tadalafileasybuy.com/# Buy Tadalafil 5mg
https://tadalafileasybuy.com/# cialis without a doctor prescription
Tadalafil Easy Buy Tadalafil Easy Buy Tadalafil Easy Buy
KamagraKopen.pro: Kamagra Kopen Online – kamagra jelly kopen
Officiele Kamagra van Nederland: kamagra 100mg kopen – Officiele Kamagra van Nederland
http://generic100mgeasy.com/# Cheap Sildenafil 100mg
https://tadalafileasybuy.shop/# Tadalafil Easy Buy
Tadalafil Easy Buy: cialis without a doctor prescription – Buy Tadalafil 20mg
Generic 100mg Easy: Generic100mgEasy – buy generic 100mg viagra online
Tadalafil Tablet Buy Tadalafil 20mg TadalafilEasyBuy.com
https://kamagrakopen.pro/# kamagra jelly kopen
http://tadalafileasybuy.com/# TadalafilEasyBuy.com
kamagra pillen kopen: kamagra kopen nederland – kamagra kopen nederland
Officiele Kamagra van Nederland: Kamagra Kopen – KamagraKopen.pro
https://generic100mgeasy.shop/# Generic 100mg Easy
https://generic100mgeasy.com/# sildenafil over the counter
over the counter sildenafil buy generic 100mg viagra online Viagra Tablet price
Tadalafil Easy Buy: Tadalafil Easy Buy – Tadalafil Easy Buy
Officiele Kamagra van Nederland: Kamagra – kamagra pillen kopen
https://kamagrakopen.pro/# kamagra 100mg kopen
https://generic100mgeasy.shop/# buy generic 100mg viagra online
canadian pharmacy in canada: InterPharmOnline – canadian pharmacy tampa
http://indiamedfast.com/# IndiaMedFast.com
https://mexicanpharminter.shop/# Mexican Pharm International
canadapharmacyonline legit
canada rx pharmacy Online pharmacy USA canadian pharmacies online
canadian pharmacies that deliver to the us: Cheapest online pharmacy – canadian neighbor pharmacy
https://indiamedfast.com/# IndiaMedFast.com
canada pharmacy reviews
http://mexicanpharminter.com/# Mexican Pharm Inter
India Med Fast: order medicines online india – india online pharmacy store
global pharmacy canada: certified canada pharmacy online – my canadian pharmacy
https://indiamedfast.com/# IndiaMedFast.com
canadian online pharmacy reviews
https://indiamedfast.shop/# india pharmacy without prescription
online canadian pharmacy review certified canada pharmacy online canadian pharmacy sarasota
cheapest online pharmacy india: online pharmacy india – online pharmacy india
http://mexicanpharminter.com/# Mexican Pharm Inter
reputable canadian pharmacy
http://mexicanpharminter.com/# mexican pharmacy online
cheapest online pharmacy india: online medicine shopping in india – IndiaMedFast.com
canadian pharmacy review: most trusted canadian pharmacies online – canada rx pharmacy
legit canadian pharmacy canada pharmacy no prescription canadian pharmacy no scripts
https://indiamedfast.com/# online medicine shopping in india
canadian pharmacy meds reviews
https://indiamedfast.shop/# India Med Fast
buying prescription drugs from india: IndiaMedFast.com – cheapest online pharmacy india
buying prescription drugs from india: online medicine shopping in india – India Med Fast
http://interpharmonline.com/# canadian pharmacy meds
real canadian pharmacy
https://interpharmonline.shop/# canada rx pharmacy world
real canadian pharmacy most trusted canadian pharmacies online canadian neighbor pharmacy
IndiaMedFast.com: online medicine shopping in india – IndiaMedFast
https://indiamedfast.com/# online medicine shopping in india
canada cloud pharmacy
https://interpharmonline.com/# canada drugs online
Mexican Pharm International mexican pharmacy online store mexican drug stores online
canadianpharmacyworld com: highest rated canadian online pharmacy – best canadian online pharmacy reviews
alo 789 dang nh?p: alo789 dang nh?p – alo 789 dang nh?p
katana