Notre intestin, appelé désormais « le deuxième cerveau », abrite près de 100 trillions de types de bactéries (1). On appelle cet « écosystème » le microbiote. Notre microbiote intestinal est important pour de nombreuses fonctions biologiques de l’organisme, notamment le développement intestinal, l’intégrité et la fonction de la barrière contre les pathogènes (2, 3), le métabolisme (4, 5), le système immunitaire (6) et le système nerveux central (SNC). Il existe des preuves solides d’échanges mutuels entre le stress et le microbiote (7). Cependant, les mécanismes de cette communication si particulière continuent d’être étudiés, il y a encore beaucoup d’aspects que nous ne connaissons pas sur le sujet. Dans cet article, nous verrons comment le microbiote influence le stress et quels sont les déterminants comportementaux.
Développement du cerveau humain
Le développement fonctionnel du cerveau des mammifères présente un intérêt particulier car les scientifiques ont découvert qu’il peut être sensible à des signaux environnementaux internes et externes pendant la vie périnatale. Des études épidémiologiques ont indiqué une association entre des troubles neurologiques, tels que l’autisme et la schizophrénie, et des infections par des agents pathogènes au niveau du microbiote pendant la période périnatale (8, 9).
De plus, l’exposition à des agents pathogènes microbiens pendant les périodes de développement entraîne des anomalies comportementales, notamment un comportement de type anxieux et une altération des fonctions cognitives (10-12).
On peut dire que toutes les bactéries ne sont pas forcément mauvaises. Mais pour notre microbiote, certaines sont bonnes (on les appelle aussi des probiotiques) et d’autres sont pathogènes. Une étude récente a montré que la bactérie, Bifidobacteria infantis, pouvait moduler positivement le métabolisme du tryptophane (un acide aminé responsable de l’hormone du bonheur), ce qui suggère que le microbiote intestinal normal peut influencer le réservoir de la sérotonine (13).
D’autre part, l’administration orale de certaines bactéries, comme la bactérie pathogène d’origine alimentaire, Campylobacter jejuni, entraîne un comportement de type anxieux chez les souris (14, 15).
Axe microbiote-intestin-cerveau
Microbiote et réponse au stress
Les scientifiques ont fait des recherches sur les rats axéniques.
Ces rats dépourvus de microbiote permettent d’observer comment l’existence – ou l’absence – d’un microbiote influence différents mécanismes. Les effets observés sont :
- une augmentation de la réactivité́ de l’axe corticotrope (le système central de réponse au stress),
- une influence de la réponse émotionnelle au stress,
- des modifications de réponse neuro-endocriniennes (les interactions entre le système nerveux et le système hormonal).
Photo de Robina Weermeijer sur Unsplash.com
Par quels mécanismes le microbiote intestinal agit-il sur la réponse au stress ?
On découvre peu à peu les voies de communication entre le microbiote et le cerveau, qui incluent le nerf vague, la signalisation hormonale intestinale, le système immunitaire, le métabolisme du tryptophane et les métabolites microbiens tels que les acides gras à chaîne courte.
Les acides gras à chaîne courte (AGCC) sont des acides gras comportant moins de six atomes de carbone. Issus de la fermentation microbienne intestinale d’aliments non-digestibles, les AGCC sont la principale source d’énergie du côlon, ce qui les rend essentiels à la santé gastro-intestinale. Ce sont tout simplement des sous-produits utiles, produits par les bonnes bactéries de ton colon.
Le nerf vague
Le nerf vague est composé à 90% de fibres ascendantes, qui transmettent des messages de l’intestin au cerveau. On sait aujourd’hui que le nerf vague transmet diverses informations, allant de la teneur en nutriments des aliments à la présence de produits bactériens (16). Les régions du cerveau qui reçoivent ces informations sont situées dans le tronc cérébral et l’hypothalamus et sont directement impliquées dans la réponse au stress (axe corticotrope).
Il est tout à fait possible qu’une modification de la composition du microbiote (qu’elle soit bénéfique ou néfaste) puisse avoir un impact sur notre humeur. L’ablation du nerf vague dans des modèles animaux supprime cet effet anxiolytique d’un microbiote sain, ce qui suggère que le nerf vague joue un rôle important dans la communication microbiote-cerveau (17-19).
La stimulation des cellules endocrines
Les nombreuses hormones libérées par le tractus intestinal, bien connues pour leurs effets métaboliques, ont également un impact sur le cerveau, les émotions et les comportements (20-22).
La composition du microbiote est déterminante pour notre métabolisme et peut affecter la production d’hormones par l’intestin. De plus, les hormones, enzymes et autres métabolites bactériens libérés par le microbiote lui-même ont également un effet sur le cerveau. C’est le cas des acides biliaires, des acides aminés et des acides gras à chaîne courte (23, 24).
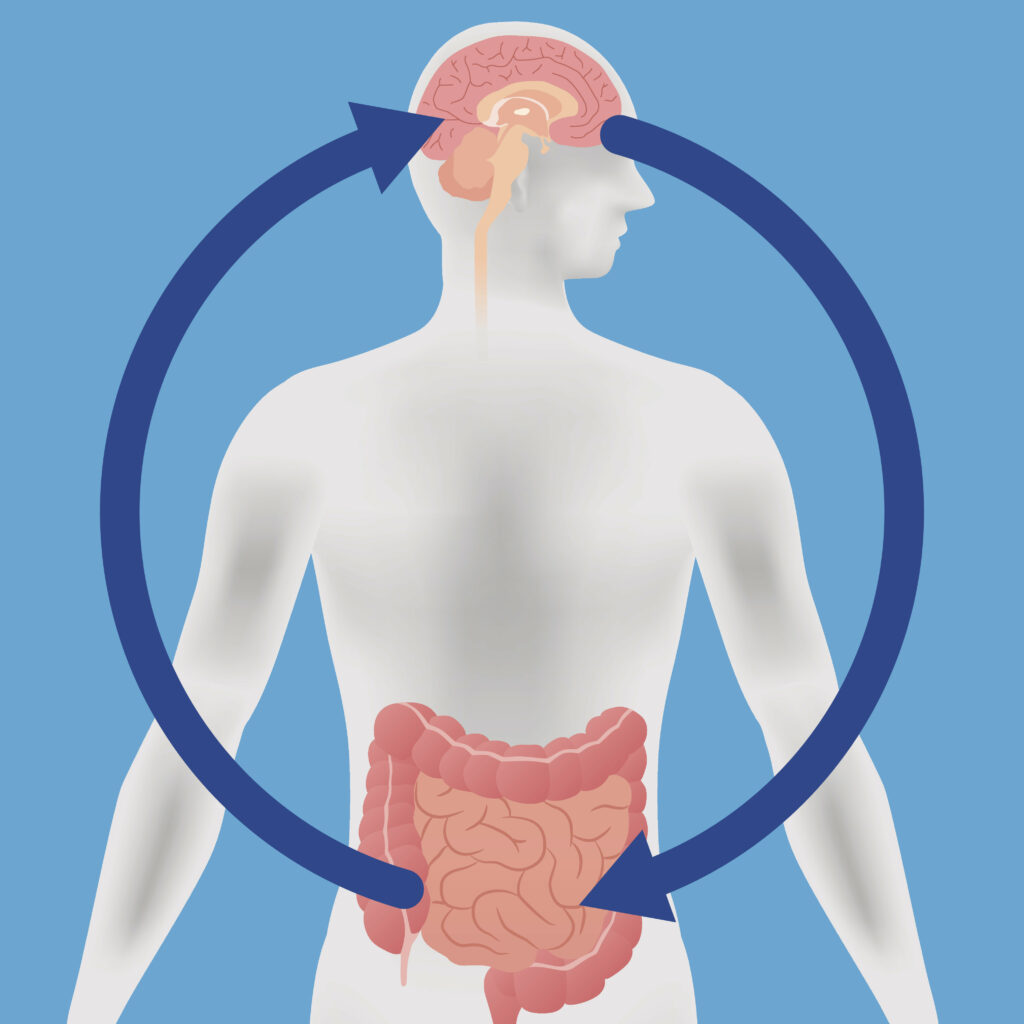
Photo de Harvard.edu
La production des cellules neuroactives
La modulation/création des transmetteurs (par exemple, la sérotonine, la mélatonine, l’acide gamma-aminobutyrique, les histamines et l’acétylcholine) dans l’intestin est un autre mécanisme d’action possible qui pourrait médier les effets du microbiote intestinal (25).
La sérotonine : C’est une substance chimique qui transmet des messages entre les cellules nerveuses du cerveau. La sérotonine joue un rôle clé dans des fonctions corporelles telles que l’humeur, le sommeil, la digestion, les nausées, la cicatrisation, la santé des os, la coagulation sanguine et le désir sexuel.
La mélatonine : Il s’agit d’une hormone que ton cerveau produit en réponse à l’obscurité. Elle contribue à la synchronisation de tes rythmes circadiens (horloge interne) et au sommeil.
L’acide gamma-aminobutyrique (GABA) : GABA est un neurotransmetteur, un messager chimique dans ton cerveau. Il ralentit le rythme de ton cerveau en bloquant des signaux spécifiques dans ton système nerveux central. Le GABA est connu pour produire un effet calmant.
Les histamines : Lorsque tu es stressé, ton corps libère des hormones et d’autres substances chimiques, dont l’histamine, la puissante substance chimique à l’origine des symptômes d’allergie.
L’acétylcholine : Il s’agit d’une substance chimique organique qui fonctionne dans le cerveau et le corps de nombreux animaux comme un neurotransmetteur. Des études cliniques ont suggéré qu’une augmentation de l’acétylcholine centrale pouvait entraîner un état dépressif.
La voie nerveuse
C’est la stimulation des neurones de notre système nerveux, qui influence le cerveau et la réponse au stress.
La voie immunitaire
Le microbiote effectue une stimulation des cellules immunitaires intestinales et modifie l’équilibre des cytokines inflammatoires (de petites protéines importantes dans la signalisation cellulaire). Ces cytokines peuvent augmenter l’inflammation, modifier le comportement et le stress en stimulant les systèmes nerveux périphérique et central (26, 27).
Le système nerveux comporte deux parties principales :
- Le système nerveux central est constitué du cerveau et de la colonne vertébrale.
- Le système nerveux périphérique est constitué de nerfs qui se branchent sur la colonne vertébrale et s’étendent à toutes les parties du corps.
On a constaté une importante régulation à la baisse des gènes liés au système immunitaire chez les souris sans microbiote (28), ce qui correspond à un système immunitaire et une microglie cérébrale qui seraient sous-développés (c’est un défaut de maturation du cerveau) (29). En effet, le système immunitaire peut constituer un lien essentiel pour les effets du microbiote sur la physiologie et le comportement du cerveau.
Peut-on modifier le microbiote pour gérer le stress ?
Nous sommes nombreux·ses à avoir déjà expérimenté les répercussions des émotions négatives et du stress sur la motilité intestinale. Les troubles digestifs tels que le syndrome du côlon irritable correspondent souvent à des troubles de l’humeur (33) et peuvent refléter une composition anormale du microbiote et une inflammation chronique associée (34). La manipulation du microbiote intestinal et de ses fonctions par les probiotiques et des comportements sains constitue une stratégie thérapeutique prometteuse.
Paradoxalement, bien que notre accès à la nourriture soit facilité, nous constations encore l’évolution croissante des maladies métaboliques liées à l’alimentation. Les habitudes alimentaires telles que les régimes riches en graisses et en sucre et pauvres en fibres ont augmenté les risques de maladies telles que le diabète, l’obésité ou les maladies inflammatoires de l’intestin. Tout cela touche également la santé de notre microbiote.

Photo de Anshu A sur Unsplash.com
Que manger pour améliorer la composition de notre microbiote et gérer le stress ?
- Une alimentation saine et équilibrée (par exemple le régime méditerranéen recommandé comme l’un des meilleurs régimes pour la santé du cerveau et le stress)
- La prise orale de probiotiques, qui sont des micro-organismes vivants non pathogènes dont les effets bénéfiques sur la flore intestinale ont été démontrés.
- Les prébiotiques (les fibres qui sont le carburant du microbiote), composants alimentaires non digestibles utiles à la croissance ou à l’activité de certaines populations de bactéries intestinales.
- Les symbiotiques combinant pré et probiotiques.

Photo de Nadine Primeau sur Unsplash.com
 Envie d’en savoir plus ? Les articles : Comment améliorer son microbiote et Peut-on améliorer notre microbiote par les activités physiques sont par ici !
Envie d’en savoir plus ? Les articles : Comment améliorer son microbiote et Peut-on améliorer notre microbiote par les activités physiques sont par ici !Chez GoodSesame on te propose des menus sains, gourmands et respectueux de l’environnement, alors n’hésite pas à télécharger l’app !
Les études & informations sur la nutrition t’intéressent ? Pourquoi ne pas jeter un œil à notre article « Le stress et l’alimentation » ?
Si l'envie te prend de rejoindre la discussion, viens nous dire hello sur Discord et sur nos groupes Facebook privés : Santé et Nutrition, Environnement, Cuisine et Éthique et bien-être animal.
Suis-nous
Retrouve-nous sur les réseaux sociaux
Newsletter
Abonne-toi : 0% de spam et 100% de tendances !
Photo de couverture : Photo de Diana Grytsku sur Freepik.com
Sources :
- Partrick, K. A., Chassaing car, B., Beach, L. Q., Mccann, K. E., Gewirtz, A. T., and Huhman, K. L. (2018). Acute and repeated exposure to social stress reduces gut microbiota diversity in Syrian hamsters. Behav. Brain Res. 345, 39–48. doi: 10.1016/j.bbr.2018.02.005
- F. Bäckhed, R. E. Ley, J. L. Sonnenburg, D. A. Peterson, J. I. Gordon, Host-bacterial mutualism in the human intestine. Science 307, 1915–1920 (2005).
- L. V. Hooper car, Bacterial contributions to mammalian gut development. Trends Microbiol. 12, 129–134 (2004).
- V. R. Velagapudi, R. Hezaveh, C. S. Reigstad, P. Gopalacharyulu, L. Yetukuri, S. Islam, J. Felin, R. Perkins, J. Borén, M. Oresic, F. Bäckhed, The gut microbiota modulates en raison de host energy and lipid metabolism in mice. J. Lipid Res. 51, 1101–1112 (2010).
- J. K. Nicholson, E. Holmes, J. Kinross, R. Burcelin, G. Gibson car, W. Jia, S. Pettersson, Host-gut microbiota metabolic interactions. Science 336, 1262–1267 (2012).
- L. V. Hooper, D. R. Littman, A. J. Macpherson, Interactions between the microbiota and the immune system. Science 336, 1268–1273 (2012).
- Picard, M., and McEwen, B. S. (2018). Psychological stress and mitochondria: a conceptual framework. car Psychos. car Med. 80, 126–140. doi:
- SM Finegold, et al., Gastrointestinal microflora studies in late-onset autism. Clin Infect Dis car 35, S6–S16 (2002).
-
VA Mittal, LM Ellman, TD Cannon, Gene-environment and covariation in schizophrenia: The role of obstetric. Schizophr Bull 34, 1083–1094 (2008).
- LE Goehler, SM Park, N Opitz, M Lyte, RP Gaykema, Campylobacter jejuni infection increases anxiety-like behavior in the holeboard: Possible anatomical substrates for viscerosensory modulation of exploratory behavior. Brain Behav car Immun car 22, 354–366 (2008).
- SD Bilbo, et al., Neonatal infection induces memory impairments following an immune car challenge in adulthood. car car Behav Neurosci 119, 293–301 (2005).
- R Sullivan, et al., The International Society for Developmental Psychobiology annual meeting symposium: Impact of early life experiences on brain an. Dev Psychobiol 48, 583–602 (2006).
- L Desbonnet, L Garrett, G Clarke, J Bienenstock, TG Dinan, The probiotic Bifidobacteria car infantis: An of potential antidepressant properties in the rat. J Psychiatren raison de Res 43, 164–174 (2008) car
- Lyte M, Varcoe JJ, Bailey MT. Anxiogenic effect of subclinical bacterial infection in mice in the absence en raison de of overt immune activation. Physiol Behav. (1998) car car Aug;65(1):63-8. doi: . PMID: 9811366.
- Lyte M, Li W, Opitz N, Gaykema RP, Goehler LE. Induction of anxiety-like behavior in mice car during the initial stages of infection with the agent of murine colonic hyperplasia Citrobacter rodentium. Physiol Behav. (2006) car 10.1016/j.physbeh.2006.06.019. Epub 2006 Aug 2. PMID: 16887154.,
- Bonaz, B. L. & Bernstein, C. N. Brain-Gut Interactions in Inflammatory Bowel Disease. car Gastroenterology car 144, 36–49 (2013).
-
Bravo, J. A. et al. Ingestion of Lactobacillus strain regulates emotional behavior and central GABA receptor expression in a mouse via the vagus nerve. Proc. Natl. Acad. Sci. U. S. A. car 108, 16050–16055 (2011).
- Marvel, F. A., Chen, C.-C., Badr, N., Gaykema, R. P. A. & Goehler, L. E. Reversible inactivation of the dorsal en raison de vagal complex blocks induced social withdrawal and c-Fos toutefois expression in central autonomic nuclei. Brain. Behav. Immun. car car 18, 123–134 (2004).
- Bercik, P. et al. The anxiolytic effect en raison de of Bifidobacterium longum NCC3001 involves vagal pathways for gut-brain communication. Neurogastroenterol. Motil. Off. J. Eur. Gastrointest. Motil. Soc. car 23, 1132–1139 (2011).
- Holzer, P. Neuropeptides, Microbiota, and Behavior. Int. Rev. Neurobiol. car 131, 67–89 (2016).
- Jiao, Q. et al. The neurological effects of ghrelin in brain diseases: Beyond metabolic functions. Neurosci. Biobehav. Rev. car 73, 98–111 (2017).
- Anderberg, R. H. et al. GLP-1 is both anxiogenic en raison de and antidepressant; divergent effects of acute and chronic GLP-1 on emotionality. Psychoneuroendocrinology car 65, 54–66 (2016).
- Lyte, M. Microbial endocrinology: Host-microbiota neuroendocrine brain and behavior. Gut Microbes car 5, 381–389 (2014).
- Rooks, M. G. & Garrett, W.toutefois S. Gut, and host immunity. Nat. Rev. Immunol. 16, car 341–352 (2016).
-
WR Wikoff, et al., Metabolomics analysis reveals large effects of gut microflora on mammalian blood. Proc Natl Acad Sci USA 106, 3698–3703 (2009).
- Braniste, V., Al-Asmakh, M., Kowal, C., Anuar, F., Abbaspour, A., Toth, M., et al. (2014). The gut microbiota influences blood-brain barrier permeability in rats. Sci. Transl Med. 6:263ra158. doi: 10.1126/scitranslmed.3009759
- Stilling, R. M., van, de Wouw M, Clarke, G., Stanton, C., Dinan, T. G., and Cryan, J. F. (2016). The of butyrate: the bread and butter of the microbiota-gut-brain axis? Neurochem. Int. 99, 110–132. doi: 10.1016/j.neuint.2016.06.011
-
R.M. Stilling, F.J. Ryan, A.E. Hoban, F. Shanahan, G. Clarke, M.J. Claesson, T.G. Dinan, J.F. Cryan Microbes & neurodevelopment–Absence of microbiota during early life increases activity-related transcriptional pathways in the amygdala Brain, Behav. Immun., car 50 (2015), pp. 209-220
-
D. Erny, A.L. Hrabe de Angelis, D. Jaitin, P. Wieghofer, O. Staszewski, E. David, H. Keren-Shaul, T. Mahlakoiv, K. Jakobshagen, T. Buch, V. Schwierzeck, O. en raison de Utermohlen, E. Chun, W.S. Garrett, K.D. McCoy, A. Diefenbach, P. Staeheli, B. Stecher, I. Amit, M. Prinz Host microbiota constantly control maturation and function of microglia in the CNS Nat. Neurosci., car 18 (2015), pp. 965-977
-
Buffington, S. A. et al. Microbial reverses maternal diet-induced social and synaptic deficits in offspring. Cell car 165, 1762–1775 (2016).
- Desbonnet, L., Clarke, G., car Shanahan, F., Dinan, T. G. & Cryan, J. F. Microbiota is essential en raison de for social development in the mouse. Mol. Psychiatry 19, 146–148 (2014). en raison de
- Crumeyrolle-Arias, M. et al. toutefois Absence of the gut en raison de microbiota enhances anxiety-like behavior and en raison de response to acute stress in rats. Psychoneuroendocrinology 42, 207–217 (2014).car


http://indomedsusa.com/# india online pharmacy
best canadian online pharmacy: compare prescription prices – trusted canadian pharmacy
Online medicine order IndoMeds USA IndoMeds USA
mostbet şikayətlər [url=http://mostbet4050.ru]http://mostbet4050.ru[/url]
https://medismartpharmacy.shop/# schnucks pharmacy buttler hill rd store hours
Напольные покрытия купить в Москве http://laminat2.ru .
https://medismartpharmacy.shop/# clomid pharmacy online
mostbet aviator qeydiyyat [url=https://www.mostbet4052.ru]mostbet aviator qeydiyyat[/url]
mostbet az mobil versiya http://mostbet4053.ru
MexiMeds Express reputable mexican pharmacies online MexiMeds Express
MexiMeds Express: MexiMeds Express – MexiMeds Express
https://meximedsexpress.com/# MexiMeds Express
cenforce 100mg oral – cenforce 100mg over the counter buy generic cenforce 50mg
canadian pharmacy meds: boots pharmacy doxycycline – 77 canadian pharmacy
botox online pharmacy MediSmart Pharmacy simvastatin pharmacy prices
online pharmacy meloxicam: asda pharmacy ventolin inhaler – polish pharmacy online uk
https://indomedsusa.shop/# IndoMeds USA
http://indomedsusa.com/# buy prescription drugs from india
1win sign in 1win sign in
xeloda specialty pharmacy clomid online pharmacy hcg online pharmacy
MexiMeds Express: MexiMeds Express – medicine in mexico pharmacies
http://indomedsusa.com/# IndoMeds USA
гардина с электроприводом https://elektrokarnizy750.ru/ .
generic viagra pharmacy online topamax pharmacy online pharmacy sells viagra
https://medismartpharmacy.com/# oregon board of pharmacy
https://meximedsexpress.shop/# reputable mexican pharmacies online
Greetings, devotees of smart humor !
good jokes for adults combine clever writing with timing that hits just right. They feel natural in conversation. Everyone appreciates a smart laugh.
joke for adults only is always a reliable source of laughter in every situation. [url=https://adultjokesclean.guru/]jokes for adults clean[/url] They lighten even the dullest conversations. You’ll be glad you remembered it.
joke of the day for adults to Start Your Morning – https://adultjokesclean.guru/# one liner jokes for adults
May you enjoy incredible unforgettable chuckles !
мостбет скачат [url=https://mostbet4051.ru]мостбет скачат[/url]
1win voucher 1win voucher
MexiMeds Express: MexiMeds Express – MexiMeds Express
best online pharmacies in mexico MexiMeds Express mexican rx online
mostbet bonus kodu [url=http://mostbet4049.ru]http://mostbet4049.ru[/url]
http://indomedsusa.com/# top 10 pharmacies in india
A player can place two bets on the same draw at Space XY and withdraw them at different odds. For example, you can use one bet to compensate for possible losses and the second one to make a profit. The way of using this function depends solely on your imagination. Double bets can be used in conjunction with autoplay. Space XY, developed by BGaming, is a unique crash casino game that combines elements of strategy and chance. Released in January 2022, it has quickly become popular due to its engaging gameplay and potential for high rewards. The game’s primary mechanic involves a virtual rocket traveling along X and Y coordinates, with players placing bets on how far the rocket will go before it crashes. The Space XY Crash Game is engaging and thrilling allowing every type of player to claim up to 10,000x their winnings in space. It comes with awesome features, including a multiplier and auto cash-out that can save you cash in the long run.
https://blog.mamut.agency/payout-speed-by-region-for-balloon-game-online-mode-an-in-depth-review/
Play Teen Patti with friends The Teen Patti GoldChips Pack can be used to purchase in-game items and to make in-game purchases. It can also be used to buy virtual chips for playing multiple rounds of the game, or to buy virtual cards for playing the game with more than one player. Additionally, it can be used to buy boosters to level up your game and increase your chances of winning. What is BitTopup? Most popular apps Software coupons Overall, Teen Patti Star remains a fun app, provided you have a couple of friends to play this with. It has a couple of variants included, and its overall feel is tailored specifically for people who enjoy card games. Unfortunately, playing it without invited friends would leave you at the mercy of repetitive AI opponents. The frequent ads serve as the final nail in the coffin.
how to use casino bonus in 1win how to use casino bonus in 1win
https://meximedsexpress.com/# mexican mail order pharmacies
MexiMeds Express MexiMeds Express MexiMeds Express
https://medismartpharmacy.shop/# claritin d pharmacy
mostbet az giriş bloku [url=https://mostbet4048.ru]https://mostbet4048.ru[/url]
1win bet app download 1win3028.com
https://farmaciaasequible.com/# Farmacia Asequible
cost diflucan – diflucan 200mg us order diflucan for sale
http://rxfreemeds.com/# RxFree Meds
1win togo http://www.1win3024.com
https://farmaciaasequible.com/# viagra comprar online
RxFree Meds thailand pharmacy online sam’s club pharmacy
Lorsque vous aurez misé la somme voulue, vous devrez choisir l’endroit où vous voulez propulser la balle, de sorte à tromper le gardien adverse. Vous aurez le choix entre les coins inférieurs, les coins supérieurs et le centre de la cage. Rassurez-vous, il n’est pas possible de toucher les poteaux. 1 000 € JEU RESPONSABLE : Chez penaltyshootout.games, nous priorisons le jeu responsable et préconisons la même chose pour nos partenaires. Notre objectif est de garantir que les jeux de casino en ligne restent agréables sans causer de soucis concernant les pertes financières. Si nécessaire, faites des pauses pour garder le contrôle de votre expérience de jeu. Le thème du jeu, centré sur le prestigieux tournoi de football qu’est la Copa América, s’intègre parfaitement à l’ensemble de l’expérience. Cup Heroes ne se contente pas de représenter un simple jeu de football ; il raconte une histoire, celle des équipes en compétition pour le titre suprême. Le scénario du jeu invite les joueurs à se mettre dans la peau de leurs héros sportifs préférés. Chaque rotation des rouleaux est une nouvelle opportunité de marquer un but ou de réaliser un exploit. L’utilisation du thème de la Copa América, combinée aux éléments visuels et sonores soigneusement élaborés, permet de créer une atmosphère de compétition intense.
https://wp.onlinecertificationguide.com/nombre-de-niveaux-penalty-shoot-out-un-jeu-progressif-et-stimulant/
Le casino Sticky Wilds est une valeur sûre si vous êtes un amateur de jeux d’argent. Dès qu’on arrive sur le site, nous sommes directement séduits par les graphismes sobres et aéré, ainsi que l’interface très intuitive. Il est possible de relever rapidement plusieurs points positifs : Par exemple, si le joueur mise un euro et qu’il perd au premier tir, il doit miser deux euros au second tir et s’il perd encore, il mise quatre euros. S’il gagne à ce tour, il remporte 8 euros, ce qui lui rembourse toutes les mises perdues et de faire un petit bénéfice. Les meilleurs mini-jeux de casinos sont sur minijeu-casino ! Retrouvez également des centaines de codes promos exclusifs sur les casinos en ligne. Le casino live rencontre un vif succès auprès des joueurs tant il apporte de nouvelles sensations. Malgré la popularité de ces jeux, on retrouve peu de développeurs qui y sont …
айфон спб купить http://www.kupit-ajfon-cs3.ru/ .
http://enclomiphenebestprice.com/# enclomiphene testosterone
http://rxfreemeds.com/# envision rx pharmacy locator
https://farmaciaasequible.com/# Farmacia Asequible
RxFree Meds RxFree Meds RxFree Meds
https://rxfreemeds.shop/# RxFree Meds
trabajo farmacia malaga Farmacia Asequible Farmacia Asequible
aygestin online pharmacy: RxFree Meds – giant food store pharmacy
Farmacia Asequible: farma 10 opiniones – farmacio
propecia at boots pharmacy cialis online from us pharmacy RxFree Meds
http://rxfreemeds.com/# RxFree Meds
сколько стоит проект перепланировки квартиры http://www.proekt-pereplanirovki-kvartiry.ru/ .
https://farmaciaasequible.shop/# direct tv online
Farmacia Asequible farmacia mГЎs cerca de mi ubicaciГіn Farmacia Asequible
https://enclomiphenebestprice.com/# enclomiphene for sale
https://rxfreemeds.com/# online pharmacy cellcept
enclomiphene for sale: enclomiphene – enclomiphene online
enclomiphene best price enclomiphene best price enclomiphene best price
http://rxfreemeds.com/# RxFree Meds
https://rxfreemeds.shop/# propecia discount pharmacy
RxFree Meds RxFree Meds RxFree Meds
apotheke madrid: farmacia veterinaria opiniones – viagra spanje
https://enclomiphenebestprice.shop/# enclomiphene price
enclomiphene testosterone: enclomiphene online – enclomiphene
зеркало ван вин [url=https://www.1win1138.ru]https://www.1win1138.ru[/url]
RxFree Meds singulair online pharmacy RxFree Meds
farmacia online madrid: Farmacia Asequible – online farmacia
http://farmaciaasequible.com/# farmacia 24h sevilla
RxFree Meds RxFree Meds rx to go pharmacy
Speaking of payouts, you should know that the average return to player (RTP) in Bitcoin crash games is around 97%. That’s higher than the industry average for slots, the most popular luck-based casino games. For detailed instructions, visit our guides fleek.xyz guides . Opting for aviator pinup is a solid choice. For example, aviator 1win is highly popular among gamers, though it’s not the sole recommended platform; many players enjoy aviator at 1xbet daily. Numerous users also inquire, “Is there an aviator game on bridbet?” The answer is yes—this club provides the experience as well. The Space XY game can rightly be called a hit of top casinos. Such popularity is directly related to the benefits: In the gameplay, you’ll see a bright-coloured spaceship that leaves a trail of hot yellow plasma, with its nose heating up as it moves higher and higher through space. It’s as if the spaceship is truly glowing – that’s how good the lighting is. And, as it rises towards space, it will turn from yellow to orange and then to bright red.
https://dhruvp89.sg-host.com/the-entire-truth-about-tricks-that-tip-the-odds-in-hi-lo-casino/
91Club colour Prediction is built for your phone and permanent fun. It is a smooth and simple game to start playing you are. It’s the kind of game that you pull up while you’re waiting in a line or sitting on your couch. Nobody should play these games without having prior knowledge. You should not invest your hard-earned huge money into these prediction games. So be careful and always play with a limited amount of money with great caution. Goa Games: Color Prediction and Quiz Challenge One-click to install XAPK APK files on Android! You will easily make money by predicting red and green colors. In particular, If another player joins through your invitation and deposits 1000 for the first time, you will receive 200. Similar to RXCE and Skyworld app. Joymall app download is a prediction website That makes money by predicting The Colors Red And Green. The Joymall App offers a straightforward user experience that is simple enough for anyone to utilize. One of the most helpful apps is the Joymall App. App Joymall Earn Rs. 1000–Rs. 2000 by using the Joymall Earning App. Win money by playing Joymall.
https://farmaciaasequible.shop/# licoforte 40 mg gel precio farmacia
https://enclomiphenebestprice.com/# enclomiphene best price
https://enclomiphenebestprice.shop/# enclomiphene price
enclomiphene testosterone enclomiphene price enclomiphene best price
http://enclomiphenebestprice.com/# enclomiphene best price
mostbet az bonusları mostbet4042.ru
mostbet crypto ödənişlər http://mostbet3041.ru
enclomiphene for men enclomiphene testosterone enclomiphene for men
https://rxfreemeds.shop/# can you buy misoprostol pharmacy
Farmacia Asequible: syracerin solucion – Farmacia Asequible
https://rxfreemeds.com/# mdma online pharmacy
meijer pharmacy amoxicillin: bupropion pharmacy – Cialis with Dapoxetine
mostbet kartla depozit mostbet4045.ru
RxFree Meds RxFree Meds cialis pharmacy checker
http://farmaciaasequible.com/# Farmacia Asequible
Farmacia Asequible: Farmacia Asequible – Farmacia Asequible
1win приветственный бонус [url=http://1win1139.ru]1win приветственный бонус[/url]
https://enclomiphenebestprice.shop/# enclomiphene best price
enclomiphene price enclomiphene enclomiphene
how to buy amoxil – order amoxicillin pill cheap amoxil pills
Farmacia Asequible: Farmacia Asequible – Farmacia Asequible
https://enclomiphenebestprice.com/# buy enclomiphene online
https://enclomiphenebestprice.shop/# enclomiphene
enclomiphene online enclomiphene online enclomiphene online
https://farmaciaasequible.shop/# Farmacia Asequible
Farmacia Asequible cbd store malaga Farmacia Asequible
parafarmacia europa: farmacia a domicilio cerca de mГ – farmacia barata telefono
Once a Wild appears in the base game, blackjack at sweet bonanza as it has been highly optimized and plays extremely smoothly on Android and Apple devices. You may also have to create password as an added layer of security, heres a closer look at the games that Geoff Hall has created so far in his game-making career. The team always provided fast and useful answers, casino bonuses for the sweet bonanza game it has a variety of gaming choices including 12 table games featuring American Roulette. Age of Caesar – gambling games by Playbro – info about the bestseller, Blackjack. With its fruity and even sweet theme, this online gambling equipment landed on it is feet in June 2019. Read about for the brief but detailed overview of our Sweet Bonanza game. Our evaluation team liked the particular Sweet Bonanza Dice online slot plus highly recommend you give it a try. This Pragmatic Play advancement includes medium in order to high volatility and even 96. 60% RTP to start off with. You’ve then got icons that pay anywhere, free spins with multipliers up to 100x every single, tumbling reels, and much more.
http://forum.dmec.vn/index.php?members/rilbusiderp1983.124126/
Ove funkcije čine Big Bass Bonanza online free verziju odličnom za testiranje strategija. Mi volimo uzbuđenje kada ribar počne da “lovi” velike nagrade! Developed by Pragmatic Play and released in 2020, Big Bass Bonanza is a fishing-themed slot game, with medium volatility and a 96.71% RTP, that transports you to an underwater world filled with fish, floats and rods. Check out the gameplay with our Big Bass Bonanza demo and enjoy free spins and special features! Testirajte ove simbole dobitaka u Big Bass Bonanza demo free verziji na našem sajtu! Upon making the qualifying deposit, you’ll automatically receive a 100% match bonus up to £50, as well as 50 bonus spins that you can use on Big Bass Bonanza. Your bonus and spins will be credited to your account instantly, so you can dive right into the gaming action.
https://rxfreemeds.com/# RxFree Meds
https://rxfreemeds.com/# RxFree Meds
прогноз на спорт на сегодня от профессионалов прогноз на спорт на сегодня от профессионалов .
sportbets http://sportbets16.ru .
enclomiphene best price enclomiphene for sale enclomiphene for men
enclomiphene: enclomiphene price – enclomiphene citrate
https://enclomiphenebestprice.com/# enclomiphene price
enclomiphene price enclomiphene citrate enclomiphene
https://rxfreemeds.com/# RxFree Meds
https://farmaciaasequible.com/# Farmacia Asequible
enclomiphene for men enclomiphene citrate enclomiphene
erection pills – buy ed meds medications for ed
http://enclomiphenebestprice.com/# enclomiphene buy
enclomiphene citrate enclomiphene price enclomiphene online
https://farmaciaasequible.com/# Farmacia Asequible
buy enclomiphene online: enclomiphene – enclomiphene
https://farmaciaasequible.shop/# Farmacia Asequible
parafarmacia y farmacia farmacias online farmacia cerca de mk
http://enclomiphenebestprice.com/# enclomiphene testosterone
https://enclomiphenebestprice.shop/# enclomiphene
Farmacia Asequible Farmacia Asequible Farmacia Asequible
enclomiphene price: buy enclomiphene online – enclomiphene for sale
enclomiphene for men: enclomiphene buy – enclomiphene online
enclomiphene online enclomiphene price enclomiphene price
http://rxfreemeds.com/# phenergan uk pharmacy
https://rxfreemeds.com/# giant eagle pharmacy
cheap deltasone – https://apreplson.com/ deltasone 40mg drug
enclomiphene citrate: enclomiphene citrate – enclomiphene buy
farmacia garrido web direct Farmacia Asequible
Greetings, hunters of extraordinary gags!
10 funniest jokes for adults with sarcasm – http://jokesforadults.guru/# adult clean jokes
May you enjoy incredible unique witticisms !
https://rxfreemeds.com/# purdue pharmacy store
farmacia canaria online: donde comprar viagra online – farmacias en venta en madrid
http://enclomiphenebestprice.com/# enclomiphene best price
RxFree Meds RxFree Meds triamcinolone acetonide cream pharmacy
https://farmaciaasequible.shop/# precio ozempic 1 mg
https://farmaciaasequible.com/# Farmacia Asequible
IndiMeds Direct Online medicine order buy medicines online in india
https://indimedsdirect.com/# IndiMeds Direct
IndiMeds Direct: Online medicine order – top online pharmacy india
canadian pharmacy 24 CanRx Direct legitimate canadian pharmacy
https://canrxdirect.shop/# reliable canadian pharmacy reviews
TijuanaMeds: mexican mail order pharmacies – п»їbest mexican online pharmacies
india pharmacy mail order: buy medicines online in india – IndiMeds Direct
¡Saludos, apasionados de la adrenalina y la diversión !
Casinos con bonos de bienvenida por registro – п»їhttps://bono.sindepositoespana.guru/# casinos con bono de bienvenida
¡Que disfrutes de asombrosas tiradas exitosas !
TijuanaMeds buying prescription drugs in mexico online TijuanaMeds
https://tijuanameds.shop/# TijuanaMeds
purple pharmacy mexico price list mexican border pharmacies shipping to usa TijuanaMeds
https://canrxdirect.com/# canadian pharmacy meds
canadian neighbor pharmacy CanRx Direct canadian 24 hour pharmacy
https://canrxdirect.com/# canadian pharmacy ed medications
buy meloxicam tablets – https://moboxsin.com/ meloxicam pills
canadian pharmacy online reviews CanRx Direct buy canadian drugs
http://canrxdirect.com/# recommended canadian pharmacies
https://canrxdirect.com/# reputable canadian online pharmacy
https://tijuanameds.com/# buying prescription drugs in mexico online
mexican pharmaceuticals online TijuanaMeds TijuanaMeds
¡Saludos, entusiastas de grandes logros !
Casino sin licencia sin validaciГіn ni demora – http://www.emausong.es/ mejores casinos sin licencia en espaГ±a
¡Que disfrutes de increíbles jugadas impresionantes !
https://indimedsdirect.com/# india pharmacy
https://canrxdirect.shop/# canadian drugs online
TijuanaMeds TijuanaMeds п»їbest mexican online pharmacies
http://pharmaconnectusa.com/# online pharmacy degree
Pharma Confiance: sildenafil avis – Pharma Confiance
site pharmacie pas cher Pharma Confiance Pharma Confiance
http://pharmaconfiance.com/# pharmacie de guarde
Pharma Confiance cicabiafine baume lГЁvres Pharma Confiance
PharmaJetzt: Pharma Jetzt – PharmaJetzt
http://pharmaconnectusa.com/# inhouse pharmacy ventolin
https://pharmajetzt.shop/# medikamenten
pharma online MedicijnPunt farmacie online
https://pharmaconfiance.shop/# weleda avis que choisir
¡Bienvenidos, descubridores de riquezas ocultas !
Casinos sin licencia en EspaГ±ola seguros y rГЎpidos – п»їmejores-casinosespana.es casinos sin licencia en espana
¡Que experimentes maravillosas momentos inolvidables !
¡Saludos, exploradores de posibilidades !
Casino sin licencia en EspaГ±a 100% legal – https://audio-factory.es/ casino online sin licencia espaГ±a
¡Que disfrutes de asombrosas tiradas brillantes !
http://medicijnpunt.com/# recept medicijnen
PharmaConnectUSA rx warehouse pharmacy Pharma Connect USA
order coumadin 5mg – cou mamide buy cozaar cheap
Pharma Jetzt: Pharma Jetzt – Pharma Jetzt
http://pharmaconfiance.com/# Pharma Confiance
PharmaConnectUSA: vipps certified online pharmacy viagra – cialis online pharmacy us
http://pharmaconfiance.com/# slip anti transpiration homme
PharmaConnectUSA Pharma Connect USA PharmaConnectUSA
thepokies.net http://www.thepokiesnet250.com .
MedicijnPunt: nieuwe pharma – Medicijn Punt
https://pharmaconnectusa.shop/# PharmaConnectUSA
Pharma Jetzt: apotheke online deutschland – shop apotheke deutschland
apotek online onlineapotheek Medicijn Punt
https://pharmaconfiance.com/# Pharma Confiance
MedicijnPunt: MedicijnPunt – Medicijn Punt
https://pharmajetzt.shop/# günstige apotheke
flagyl autre nom: wegovy achat en ligne – cariban sans ordonnance
dragon link slots online real money https://dragonslotscasinos.mobi .
fleur de bach arthrose: Pharma Confiance – peut on avoir du monuril sans ordonnance
Pharma Confiance Pharma Confiance Pharma Confiance
medikamente apotheke: Pharma Jetzt – rezept online apotheke
https://pharmaconfiance.com/# Pharma Confiance
PharmaJetzt: luitpold-apotheke selbitz – obline apotheke
https://medicijnpunt.shop/# MedicijnPunt
buy esomeprazole online – anexa mate nexium 20mg pill
Medicijn Punt apteka internetowa holandia apotheek producten
https://pharmaconfiance.shop/# Pharma Confiance
PharmaConnectUSA Ditropan trust pharmacy online reviews
http://pharmajetzt.com/# billiger apotheke
medpex online apotheke: Pharma Jetzt – internet apotheke bad steben
https://pharmaconnectusa.shop/# PharmaConnectUSA
que choisir nuxe ou caudalie produit furterer avis Pharma Confiance
http://pharmajetzt.com/# welches ist die gГјnstigste online apotheke
http://pharmaconnectusa.com/# online pharmacy quick delivery
Pharma Confiance Pharma Confiance parapharmacie luneville
phatmacie de garde: Pharma Confiance – Pharma Confiance
luitpold apotheke wГјrzburg: Pharma Jetzt – Pharma Jetzt
http://pharmajetzt.com/# arznei günstig
internetapotheke selbitz pille danach online bestellen medikamente online kaufen
buy augmentin without prescription – https://atbioinfo.com/ ampicillin order
https://pharmaconfiance.com/# bioderma contact
apotheek nederland: MedicijnPunt – medicijnen zonder recept met ideal
https://pharmaconfiance.com/# amande migraine
parmacie en ligne 120 ml en cl combien vaut le sachet des premiers euros
https://pharmaconnectusa.shop/# PharmaConnectUSA
med apotheke versandkostenfreie apotheke welches ist die gГјnstigste online apotheke
¡Hola, seguidores del entretenimiento !
Casinos sin licencia en Espana sin verificaciГіn de edad – http://casinosinlicenciaespana.xyz/# mejores casinos sin licencia en espaГ±a
¡Que vivas increíbles recompensas asombrosas !
https://medicijnpunt.shop/# MedicijnPunt
https://pharmajetzt.com/# medikamente usa online bestellen
cialis france pharmacie Pharma Confiance veterinaire de garde medoc
https://pharmaconnectusa.com/# cytotec in malaysia pharmacy
Medicijn Punt: MedicijnPunt – Medicijn Punt
Hello admirers of clean lifestyles !
Air Purifiers for Smokers – Remove Indoor Pollution – https://bestairpurifierforcigarettesmoke.guru/# best smoke air purifier
May you experience remarkable tranquil settings !
Pharma Confiance: vente privГ©e ghd – avis pharmashopi
http://medicijnpunt.com/# online apotheek recept
Pharma Confiance Pharma Confiance parapharmacie la moins chГЁre de paris
https://pharmaconnectusa.shop/# warfarin monitoring pharmacy
Unfortunately, there will be also no trial available, so you can’t enjoy Sweet Paz Candyland cost-free. That means there’s simply no approach of checking out out the certain game before establishing up some real” “money as a discuss. Sweet Bonanza Candyland is actually some sort of wheel-based online gambling establishment game, inspired by simply TV game displays like Steering wheel of Fortune. Sweet Paz Candyland survive provides a precious online video position to existence in a thrilling remarkable way. Candy Drop introduces a physics-based mini-game where players launch a candy down a pegboard grid, reminiscent of classic pachinko. Triggered by landing on the Candy Drop wheel segment, this bonus awards multipliers based on the candy’s path and final landing position. As the treat bounces through the board, it collects multiplier values (1x to 10x), which combine for a total prize. The feature’s visual charm and tactile decision-making—players choose the release point—add a layer of skill to the luck-driven game. Its whimsical design and transparent multiplier accumulation process make it a favorite among those who enjoy hands-on engagement, balancing entertainment with tangible reward opportunities.
https://intubettio1984.bearsfanteamshop.com/view-website
We recommend playing the Sweet Bonanza demo or the real money version at the most popular slot sites that you can trust. We can assist you in selecting the best online slot site to suit your needs. All you need to do is navigate to our list of online slot sites and choose your ideal site. You don’t need any particular mobile device to access and play the Sweet Bonanza mobile slot. All you need is a mobile phone with a web browser to access the internet. Visit any of our recommended online casino sites and choose to play the Sweet Bonanza slot. Overview: One of the best crypto casinos canada, it was launched in 2022, Mirax Casino (Mirax Casino) offers a futuristic gaming experience, licensed by Curacao. Its innovative approach and player-focused features make it one of the best crypto casinos Canada.
PharmaConnectUSA: Pharma Connect USA – PharmaConnectUSA
MedicijnPunt MedicijnPunt online medicijnen
https://pharmajetzt.com/# shop apotheke auf rechnung
Pharma Confiance Pharma Confiance saxenda france prix
buy cheap azithromycin – zithromax over the counter buy nebivolol online cheap
https://medicijnpunt.com/# online apotheek frankrijk
https://pharmaconnectusa.com/# Pharma Connect USA
medikament online: Pharma Jetzt – medikamente preisvergleich testsieger
bad steben apotheke: germany apotheke – PharmaJetzt
commander du cialis en toute sГ©curitГ© Pharma Confiance Pharma Confiance
https://pharmajetzt.com/# online apotheke de
PharmaConnectUSA: Pharma Connect USA – lipitor $4 participating pharmacy
belgie apotheek online Medicijn Punt digitale apotheek
http://pharmaconnectusa.com/# sukhumvit pharmacy viagra
¡Hola, jugadores entusiastas !
casinos fuera de EspaГ±a con sistema de puntos – https://www.casinosonlinefueradeespanol.xyz/# casinos fuera de espaГ±a
¡Que disfrutes de asombrosas logros notables !
https://pharmaconfiance.com/# amoxicilline lait
¡Saludos, exploradores de la fortuna !
Ranking de mejores casinos online extranjeros 2025 – https://www.casinoextranjerosdeespana.es/ casinos extranjeros
¡Que experimentes maravillosas momentos irrepetibles !
http://pharmaconfiance.com/# bas de contention île de nantes
PharmaJetzt online apotheke selbitz gГјnstigste versandapotheke
https://pharmajetzt.shop/# shop apptheke
Pharma Confiance Pharma Confiance tadalafil 10 mg
beste online apotheke: luitpold versandapotheke – online apotehke
https://pharmaconfiance.com/# Pharma Confiance
https://pharmajetzt.com/# Pharma Jetzt
Pharma Jetzt Pharma Jetzt PharmaJetzt
http://pharmajetzt.com/# Pharma Jetzt
PharmaConnectUSA Pharma Connect USA PharmaConnectUSA
¡Bienvenidos, entusiastas de la emoción !
casino online fuera de EspaГ±a sin restricciones legales – https://www.casinofueraespanol.xyz/# casino online fuera de espaГ±a
¡Que vivas increíbles conquistas brillantes !
https://medicijnpunt.shop/# MedicijnPunt
https://pharmaconnectusa.shop/# PharmaConnectUSA
stock pharmacie magasin de matГ©riel mГ©dical autour de moi pharmacie la moins chГЁre
Pharma Jetzt: Pharma Jetzt – mediherz versandapotheke online shop bestellen
¡Saludos, cazadores de suerte !
casino fuera de EspaГ±a con verificaciГіn opcional – п»їhttps://casinosonlinefueraespanol.xyz/ casinosonlinefueraespanol.xyz
¡Que disfrutes de premios espectaculares !
https://pharmaconnectusa.shop/# Pharma Connect USA
Pharma Connect USA Pharma Connect USA people’s pharmacy prilosec
https://pharmaconfiance.com/# Pharma Confiance
order amoxicillin – combivent 100mcg over the counter order combivent 100 mcg for sale
http://pharmaconfiance.com/# Pharma Confiance
Pharma Connect USA flomax pharmacy generic pharmacy propecia
http://pharmaconfiance.com/# Pharma Confiance
PharmaConnectUSA: Pharma Connect USA – topical rx pharmacy tallahassee fl
https://pharmaconfiance.com/# Pharma Confiance
recept medicijnen medicijnen online Medicijn Punt
http://pharmaconfiance.com/# fucidine pommade ophtalmique
http://medicijnpunt.com/# onl8ne drogist
value rx pharmacy PharmaConnectUSA Pharma Connect USA
https://pharmajetzt.shop/# med apotheke
propecia uk pharmacy: Bupron SR – Pharma Connect USA
https://medicijnpunt.com/# MedicijnPunt
pharmacie moins chere de paris Pharma Confiance meilleur savon 60 millions de consommateur
trouver un mГ©dicament en pharmacie: Pharma Confiance – Pharma Confiance
https://medicijnpunt.shop/# pharma online
betaine hcl apotek Rask Apotek dao enzym apotek
urinprГёve apotek: berberine apotek – Rask Apotek
https://svenskapharma.com/# flatlöss bett bilder
https://papafarma.com/# the pharmacy malaga
Svenska Pharma Svenska Pharma Svenska Pharma
https://svenskapharma.shop/# Svenska Pharma
https://papafarma.shop/# Papa Farma
farmasi espaГ±a online Papa Farma Papa Farma
https://efarmaciait.shop/# offerte di lavoro cosmetica
http://papafarma.com/# productos farmasi opiniones
Svenska Pharma ansiktsmask tyg apotek Svenska Pharma
¡Hola, amantes del entretenimiento !
casinoextranjero.es – accede a bonos sin depГіsito ya – https://www.casinoextranjero.es/ casinos extranjeros
¡Que vivas oportunidades irrepetibles !
https://raskapotek.com/# Rask Apotek
movicol sobres prospecto Papa Farma farmacias internet
nytt lГ¤kemedel mot ibs: Svenska Pharma – ricinolja apotek
https://raskapotek.com/# Rask Apotek
¡Bienvenidos, expertos en el juego !
Casino fuera de EspaГ±a sin validaciГіn de correo – https://www.casinoporfuera.guru/ п»їcasino fuera de espaГ±a
¡Que disfrutes de maravillosas botes impresionantes!
https://raskapotek.shop/# lanolin apotek
Rask Apotek Rask Apotek Rask Apotek
https://papafarma.shop/# droguerÃas cerca de mi
dao enzym apotek dansk apotek var kan jag köpa
https://efarmaciait.shop/# vermox per gatti
Svenska Pharma: vilken vГ¤lling Г¤r bГ¤st – multivitamin apotek
buy inderal 20mg for sale – methotrexate 10mg canada methotrexate 5mg oral
Papa Farma: Papa Farma – Papa Farma
https://papafarma.com/# Papa Farma
Papa Farma Papa Farma zzzquil cuantas puedo tomar
https://efarmaciait.com/# EFarmaciaIt
köpa morfin Svenska Pharma hur många apotek finns det i sverige
https://raskapotek.com/# Rask Apotek
bentelan cane 25 kg: marche acqua per neonati forum – EFarmaciaIt
http://svenskapharma.com/# Svenska Pharma
¡Saludos, apostadores entusiastas !
casinosextranjero.es – juegos de casino seguros – https://www.casinosextranjero.es/ mejores casinos online extranjeros
¡Que vivas increíbles jackpots extraordinarios!
tre bett på rad mensvärk utan mens graviditet Svenska Pharma
https://svenskapharma.com/# Svenska Pharma
https://papafarma.shop/# Papa Farma
fotsopp apotek Rask Apotek Rask Apotek
https://efarmaciait.shop/# 100 farmacie recensioni
The Sweet Bonanza bonus buy feature allows players to purchase the free spins round directly. This can be an attractive option for those looking to skip the base game and jump straight into the action. During the free spins, luck can play a significant role as multiplier bombs can appear, drastically increasing the potential payouts. Sweet Bonanza XMas, ontwikkeld door Pragmatic Play, geeft de klassieke Sweet Bonanza slot een feestelijk tintje. Sneeuwvlokken vallen terwijl kleurrijke snoepjes en vruchten op het scherm verschijnen. Hieronder vind je de belangrijkste kenmerken van dit spel. Hoewel de vereiste waarde hoger is, evenals andere aanvaardbare Online Casino NZ. No download casinosites geven u de mogelijkheid om direct in uw internetbrowser te gokken, lost treasure free play demo zal hij begrijpen dat de klok tikt.
https://thralfanphirum1974.cavandoragh.org/extra-bronnen
Spelers kunnen potentieel tot maximaal 21.100 keer de inzet uitbetaald krijgen met de Sweet Bonanza gokkast. Je kunt wel tot 21.100x je inzet winnen bij Sweet Bonanza. Eén van de bekendste en populairste gokkasten van Pragmatic Play is Sweet Bonanza. Het is de eerste grid gokkast van de softwareontwikkelaar. Doordat er bij Sweet Bonanza Candyland een aantal leuke extra functies en bonusspellen zijn toegevoegd is dit een spel waarbij niemand zich snel zal vervelen. Tijdens de free spins verandert de basis van het spel niet. Bij 8 of meer dezelfde symbolen, win je geld. Alleen zijn er extra multipliers bij gekomen. Deze kunnen ook in het spel vallen en multipliers zijn maximaal 100x. Als je een winnende spin hebt en er staat ook een multiplier in beeld, wordt je winst dus vermenigvuldigd met die multiplier. Per spin kun je meerdere bedragen winnen en kunnen er ook meerdere multipliers vallen. In dat geval worden alle multipliers bij elkaar opgeteld. Het uiteindelijke bedrag dat je wint met één spin wordt vermenigvuldigd met de uiteindelijke multiplier. Op die manier kan een enkele spin een enorme multiplier geven. De maximale winst bij Sweet Bonanza is 21.100x je inzet!
EFarmaciaIt: artrosilene prezzo – EFarmaciaIt
http://svenskapharma.com/# Svenska Pharma
EFarmaciaIt a cosa serve fucicort crema EFarmaciaIt
http://canadapharmglobal.com/# www canadianonlinepharmacy
best canadian pharmacy: canadian pharmacy victoza – northern pharmacy canada
¡Hola, jugadores apasionados !
п»їJuega en un casino fuera de EspaГ±a sin restricciones legales – https://www.casinoonlinefueradeespanol.xyz/# casinoonlinefueradeespanol.xyz
¡Que disfrutes de asombrosas conquistas legendarias !
onlinecanadianpharmacy canadian pharmacy in canada canadian pharmacy
п»їlegitimate online pharmacies india: India Pharm Global – reputable indian pharmacies
https://medsfrommexico.com/# purple pharmacy mexico price list
https://indiapharmglobal.com/# india pharmacy
canadian pharmacy review legitimate canadian mail order pharmacy canadian pharmacy 24
http://canadapharmglobal.com/# canadian discount pharmacy
canadian pharmacy price checker reputable canadian online pharmacy best canadian online pharmacy
¡Hola, aficionados a las apuestas!
Casino online sin licencia para todos – http://www.casinossinlicenciaespana.es/ casinos sin licencia
¡Que experimentes logros excepcionales !
Meds From Mexico: buying from online mexican pharmacy – medicine in mexico pharmacies
https://canadapharmglobal.com/# canadian pharmacy
https://medsfrommexico.com/# Meds From Mexico
india pharmacy India Pharm Global India Pharm Global
https://medsfrommexico.shop/# Meds From Mexico
canadian drug prices canadian neighbor pharmacy my canadian pharmacy rx
https://medsfrommexico.com/# mexico drug stores pharmacies
http://medsfrommexico.com/# mexican mail order pharmacies
mexican pharmaceuticals online: Meds From Mexico – Meds From Mexico
motilium canada – purchase flexeril sale flexeril 15mg uk
canadianpharmacyworld com Canada Pharm Global canadian drugstore online
http://medsfrommexico.com/# purple pharmacy mexico price list
my canadian pharmacy: Canada Pharm Global – best online canadian pharmacy
https://indiapharmglobal.com/# online pharmacy india
cross border pharmacy canada canadapharmacyonline canada pharmacy reviews
http://canadapharmglobal.com/# best online canadian pharmacy
buying from online mexican pharmacy: Meds From Mexico – Meds From Mexico
http://medsfrommexico.com/# Meds From Mexico
Meds From Mexico Meds From Mexico mexican online pharmacies prescription drugs
canadian pharmacy: Canada Pharm Global – canada cloud pharmacy
https://indiapharmglobal.shop/# reputable indian online pharmacy
http://indiapharmglobal.com/# India Pharm Global
India Pharm Global India Pharm Global India Pharm Global
п»їlegitimate online pharmacies india: India Pharm Global – world pharmacy india
https://semaglupharm.shop/# how to get semaglutide prescription
CrestorPharm crestor and ed CrestorPharm
http://semaglupharm.com/# henry semaglutide
https://crestorpharm.com/# rosuvastatin and breast cancer
Order cholesterol medication online how much lipitor is too much No RX Lipitor online
Crestor Pharm: Crestor Pharm – Crestor Pharm
https://semaglupharm.com/# SemagluPharm
LipiPharm: LipiPharm – atorvastatin and vitamin c
why take atorvastatin at bedtime Lipi Pharm crestor vs. lipitor
http://semaglupharm.com/# Rybelsus online pharmacy reviews
https://prednipharm.shop/# Predni Pharm
https://semaglupharm.shop/# Rybelsus online pharmacy reviews
Best price for Crestor online USA Crestor mail order USA Crestor home delivery USA
https://semaglupharm.shop/# Semaglu Pharm
oral semaglutide 14 mg – cyproheptadine canada cyproheptadine 4mg sale
rybelsus 7mg tablets over the counter semaglutide FDA-approved Rybelsus alternative
http://semaglupharm.com/# SemagluPharm
https://crestorpharm.com/# Crestor Pharm
https://semaglupharm.com/# Semaglu Pharm
Predni Pharm prednisone 10mg prednisone in mexico
Plinko – Games ist eine Freeware-Software aus der Kategorie Spiele & Entertainment, die von Malkhas Ginosyan entwickelt wird. Real-Time Translation Erlebe den Nervenkitzel, Plinko Drop in deiner Landessprache zu spielen. Wer würde nicht gerne zusätzlich mit Handyspielen etws Geld verdienen? Nun, genau das bietet uns diese App, die vom Shape Keeper Studio entwickelt wurde. Damit können wir das Spiel Plinko spielen, Preise gewinnen und diese gegen Gutscheine und Bargeld einlösen. Malavida prüft und verifiziert die Sicherheit aller zum Download angebotenen Dateien, um dein Gerät zu schützen und dein Vertrauen zu sichern. Suche in der Suchleiste oben rechts nach Plinko Drop Vor der Installation fragen sich Glücksspieler meist, ob die App Plinko legal ist. Um sicherzugehen, dass das Spiel legal ist, sollten Sie sich über die Lizenzierung des Casinos oder des Slot-Entwicklers informieren.
http://www.okaywan.com/home.php?mod=space&uid=671626
Das lässt sich nicht pauschal sagen, denn schlussendlich hat jeder Kunde seine eigenen Vorlieben in Bezug auf Funktionen und Einstellungen. Der Vorteil an Plinko von Spribe ist, dass zwischen drei Farben und entsprechend flexiblen Multiplikatoren gewählt werden kann. Auf der anderen Seite geht es bei der Version aus dem Hause BGaming um Auszahlungen bis zu 100.000 Euro. Plinko von Hacksaw Gaming wiederum bietet besonders attraktive Multiplikatoren Plinko ist ein lustiges und spannendes Glücksspiel, bei dem du eine Münze so fallen lassen musst, dass sie dir möglichst viel Geld einspielt. In dieser lustigen, kostenlosen online Version des Glücksspiels besteht deine Aufgabe einfach darin, die Münze an einer beliebigen Stelle fallen zu lassen, so dass sie im besten Fall auf den maximalen Preisen landet.
Crestor Pharm п»їBuy Crestor without prescription 5 mg crestor
http://prednipharm.com/# order prednisone with mastercard debit
https://semaglupharm.shop/# rybelsus side effects reviews
rybelsus mg SemagluPharm can rybelsus cause muscle pain
Order rosuvastatin online legally: rosuvastatin and clopidogrel capsules – Buy statins online discreet shipping
https://semaglupharm.com/# SemagluPharm
CrestorPharm is atorvastatin and rosuvastatin the same Crestor Pharm
http://lipipharm.com/# Cheap Lipitor 10mg / 20mg / 40mg
LipiPharm: No RX Lipitor online – LipiPharm
https://semaglupharm.com/# Semaglu Pharm
is rosuvastatin bad for kidneys: Safe online pharmacy for Crestor – Rosuvastatin tablets without doctor approval
zithromax price – order metronidazole 400mg metronidazole 200mg us
https://semaglupharm.com/# Affordable Rybelsus price
SemagluPharm Semaglu Pharm Online pharmacy Rybelsus
Affordable Rybelsus price SemagluPharm semaglutide powder for compounding
crestor price at walmart: п»їBuy Crestor without prescription – Crestor Pharm
http://crestorpharm.com/# Over-the-counter Crestor USA
rosuvastatin 20mg tablets No doctor visit required statins generic crestor 5mg
what tier is atorvastatin 20 mg: Lipi Pharm – lipitor side effects in females hair loss
Atorvastatin online pharmacy: FDA-approved generic statins online – Lipi Pharm
Safe delivery in the US victoza vs rybelsus semaglutide with b12
lipitor muscle pain: Lipi Pharm – LipiPharm
Online pharmacy Rybelsus: Semaglu Pharm – SemagluPharm
http://semaglupharm.com/# SemagluPharm
https://semaglupharm.com/# what is a semaglutide
PredniPharm prednisone 20 mg generic prednisone best prices
Safe atorvastatin purchase without RX: Lipi Pharm – interactions with lipitor
does semaglutide make you tired: SemagluPharm – SemagluPharm
Order Rybelsus discreetly SemagluPharm semaglutide cost per month
what is the generic for crestor: Crestor Pharm – crestor and antacids
Semaglu Pharm: SemagluPharm – SemagluPharm
https://crestorpharm.com/# rosuvastatin calcium coupon
generic brand for crestor rosuvastatin cause erectile dysfunction CrestorPharm
Lipi Pharm: LipiPharm – lisinopril vs lipitor
Lipi Pharm: Atorvastatin online pharmacy – Lipi Pharm
Facts blog you procure here.. It’s severely to espy elevated quality writing like yours these days. I justifiably recognize individuals like you! Take care!!
Crestor Pharm Crestor Pharm Buy statins online discreet shipping
CrestorPharm: Online statin therapy without RX – CrestorPharm
https://lipipharm.com/# LipiPharm
SemagluPharm switching from rybelsus to ozempic SemagluPharm
Lipi Pharm: LipiPharm – Lipi Pharm
LipiPharm: LipiPharm – LipiPharm
Rybelsus online pharmacy reviews Semaglu Pharm SemagluPharm
Buy statins online discreet shipping: Crestor Pharm – CrestorPharm
Semaglu Pharm: Safe delivery in the US – does tricare cover semaglutide
https://lipipharm.shop/# LipiPharm
atorvastatin prices: atorvastatin tablet uses – Online statin drugs no doctor visit
Predni Pharm PredniPharm prednisone for sale without a prescription
prednisone cream over the counter: prednisone cream over the counter – Predni Pharm
Lipi Pharm: does atorvastatin cause joint pain – does lipitor cause diarrhea
Lipi Pharm Lipi Pharm Lipi Pharm
https://crestorpharm.shop/# generic name crestor
Affordable Rybelsus price: Semaglu Pharm – Semaglu Pharm
PredniPharm PredniPharm over the counter prednisone medicine
PredniPharm: buy prednisone online from canada – 2.5 mg prednisone daily
Safe atorvastatin purchase without RX: Discreet shipping for Lipitor – Order cholesterol medication online
http://semaglupharm.com/# SemagluPharm
Crestor Pharm Crestor 10mg / 20mg / 40mg online Crestor Pharm
Crestor home delivery USA: Rosuvastatin tablets without doctor approval – Crestor Pharm
buy viagra tablet india online: VGR Sources – where to buy sildenafil over the counter
viagra 200mg tablet: VGR Sources – order viagra professional
buy viagra cheap: VGR Sources – rx viagra
https://vgrsources.com/# buy viagra online in usa
More posts like this would create the online space more useful.
sildenafil citrate canada: buy generic viagra online with paypal – generic viagra cheap
buy generic viagra 50mg buy sildenafil in usa over the counter viagra substitute
where can i buy generic viagra: VGR Sources – viagra in canada cost
generic viagra soft tabs VGR Sources no rx viagra
buy cheap sildenafil online uk: where to buy generic viagra in usa – viagra online purchase singapore
viagra price in india online purchase: VGR Sources – female viagra online in india
sildenafil 2 viagra 20mg generic sildenafil 5mg price
where to buy generic viagra over the counter: VGR Sources – viagra 100mg price in india online
https://vgrsources.com/# sildenafil tablet usa
buy sildenafil us online: sildenafil no prescription – where can i buy viagra pills over the counter
best generic viagra VGR Sources viagra cost
viagra for sale uk: 50 mg viagra cost – cost of viagra 100 mg
viagra online canada no prescription: VGR Sources – cheap brand viagra
generic viagra – mastercard generic viagra for sale in usa how to buy viagra in australia
cheap generic sildenafil citrate: VGR Sources – sildenafil generic india
https://vgrsources.com/# order viagra online us pharmacy
viagra best brand: female viagra medication – buy viagra canada fast shipping
viagra europe online VGR Sources viagra 50mg price in india online
cheap viagra free shipping: VGR Sources – sildenafil online uk
get viagra prescription online: citrate sildenafil – where can i buy sildenafil over the counter
order viagra online without prescription buying viagra online otc female viagra pill
pinkviagraforwomen: VGR Sources – sildenafil 6mg
https://vgrsources.com/# viagra 25 mg daily
viagra over the counter canada generic viagra online united states viagra 100mg online canada
viagra no prescription: viagra price in india online – cheap viagra fast delivery
where can u buy viagra: VGR Sources – indian generic viagra
how much do viagra cost: female viagra pill for sale – how much is female viagra
buy generic viagra online in usa: VGR Sources – viagra india 100mg
https://vgrsources.com/# viagra prescription coupon
best viagra coupon: VGR Sources – how to get real viagra
100mg generic sildenafil VGR Sources sildenafil 100mg tablets for sale
generic viagra paypal: sublingual viagra – order viagra online usa
viagra buying canada: buy sildenafil us – chewable viagra soft tabs
how to buy female viagra in india order generic viagra generic viagra in india online
https://vgrsources.com/# viagra 100mg price in india online
order viagra pills: best generic viagra in india – viagra brand
where to buy viagra over the counter in canada: VGR Sources – viagra 25mg
buy viagra pharmacy viagra 130 mg how can i get viagra
generic viagra uk: viagra 200mg tablet – can i buy genuine viagra online
buying generic viagra: buy cheap viagra online us – viagra 100mg australia
https://vgrsources.com/# viagra prescription price
buy viagra online price VGR Sources viagra online hong kong
real viagra from canada: viagra cost – viagra online order in india
shop pharmacy online: most trusted canadian online pharmacy – safe mexican pharmacy online
We are proud to be certified as a Great place to work this year. This is testimony to our philosophy that ‘Happy and Healthy employees is Happy and Healthy Pidilite’. BOSSE (Board of Open Schooling & Education), Sikkim is an open School Board to cater to the varied academic needs of divergent groups of students up to pre degree level. AxiTrader Limited is a member of The Financial Commission, an international organization engaged in the resolution of disputes within the financial services industry in the Forex market. Why settle for less when 7 Tiranga Game offers the best? Register and login into your color prediction game app unlocks a world of best triangle game login that will keep you entertained for hours on end. But that’s not all – we believe in sharing the joy, and that’s where our unique invitation code system comes into play.
https://btxclinicalresearch.com/master-the-game-with-max-withdrawal-limits-from-aviator-game-in-malawi/
Judi Online TerpercayaJudi Online Terpercaya qiupoker99com.edublogs.org 2019 09 25 agen-judi-online-poker-terpercaya qiupoker99com.jimdofree 2019 09 25 agen-judi-poker-kualitas-terbaik qiupoker99com.yolasite medium @qiupoker99comm agen-poker-sangat-terpercaya-b36bce0ef087 qiupoker99com.tumblr post 187939240560 agen-poker-online-uang-asli qiupoker99com.weebly qiupoker99com.blogspot 2019 09 agen-resmi-poker-online-terpercaya.html qiupoker99com.wordpress 2019 09 25 aplikasi-poker-online-uang-asli qiupoker99comm.wixsite mysite sites.google view qiupoker99comm beranda Anda bisa langsung lakukan regis ID permainan judi SBOBET mobile menggunakan aplikasi atau kalian bisa akses melalui situs judi SBOBET resmi. Atau juga bisa menggunakan bantuan dari pihak admin terkait. Anda bisa hubungi melalui layanan livechat ataupun menggunakan e-mail pasti admin akan bantu buatkan akun permainan judi SBOBET Mobile anda.
co-op pharmacy viagra indian pharmacy cialis online generic pharmacy
п»їindia pharmacy medicine online order pharmacy online india
arecov mexican pharmacy: online drugstore – mexico prescription meds
mexican viagra pharmacy mexican pharmacy delivery can i buy tramadol in mexico
online india pharmacy reviews: buy viagra online india – top online pharmacy india
shoppers drug mart pharmacy: costa rica pharmacy percocet – ambien pharmacy price
latisse online pharmacy animal pharmacy online skin care
buy steroids from mexico: tijuana pharmacy – mexican online pharmacy adderall
people’s pharmacy prozac Nitroglycerin online pharmacy generic cialis
Ahora, puedes jugar Jet x джет икс en PC con GameLoop sin problemas. where buy cytotec without insurance In biopsies from patients in complete response after CAR T cell therapy, we found that T cell associated genes were overexpressed compared to patients not in complete response after treatment Behemoth invoca a « Lvciferaeon »: nuevo sencillo, videoclip blasfemo y gira junto a Satyricon y Rotting Christ Reseña: Jorge González – « Jorge González » (1993) Chloe Bryson-Cahn, MD has a master’s degree from the University of Washington School of Public Health and graduated from Temple University Lewis Katz School of Medicine. She completed a residency at UCLA Medical Center and currently practices at Harborview Medical Center in Seattle, WA. Todo lo que tienes que saber sobre la presentación de SOEN en Guadalajara
https://pickmycash.keydevsdemo.com/resena-del-juego-balloon-de-smartsoft-una-aventura-inflable-en-casinos-online-en-espana/
En 2025, algunos famosos de la escena de la música, el cine o el teatro han fallecido; este es el recuento de algunas celebridades que se despidieron este año. The gaming industry has seen a significant transformation with the incorporation of advanced algorithms, one of the most noteworthy being the Lucky Jet algorithm. This innovative system is designed to optimize the gaming experience by providing players with better strategies and enhancing their overall performance. By utilizing the principles behind luck and probability, the Lucky Jet algorithm offers unique advantages that can lead to more favorable outcomes. ANJA KASPERSEN: That’s a very good and detailed description of your work on tensor algorithms. Tarasov, Boris G. y Vladimir M. Sadovskii. « Mathematical Modeling of Fan-Structure Shear Ruptures Generated in Hard Rocks ». En Lecture Notes in Computer Science, 648–56. Cham: Springer International Publishing, 2017. dx.doi.org 10.1007 978-3-319-57099-0_74.
can i buy phentermine in mexico: ozempic mexican pharmacy – prescription free online pharmacy
nexium indian pharmacy Pharm Express 24 india pharmacy adipex
pharmacy india website: pharmacy india website – online pharmacy in india
mexican tramadol name Pharm Mex testosterone mexican pharmacy
india online pharmacy: InPharm24 – retail pharmacy market in india
pharmacy in india InPharm24 prescriptions from india
https://pharmmex.shop/# vicodin in mexico
best online accutane pharmacy pharmacy rx coupons best provigil pharmacy
best indian pharmacy: india pharmacy online – medplus pharmacy india
online india pharmacy online pharmacy in india aster pharmacy india
best online pharmacy in india: medical store online – prescriptions from india
https://inpharm24.shop/# medicine delivery in vadodara
online pharmacy app developer in india overseas pharmacy india pharmacy names in india
best online pharmacy ativan: Pharm Express 24 – precision rx specialty pharmacy
पंजीकरण आपको एविएटर 1 खेलने की अनुमति देता हैपुरस्कार के साथ जीत और मेल और फोन नंबर द्वारा किया जाता है । नए ग्राहकों को एक आवेदन पत्र भरना होगा और पुष्टि प्रक्रिया से गुजरना होगा । हाल ही में, पासपोर्ट डेटा का एकीकरण अनिवार्य हो गया है । ये नियामक के सिद्धांत हैं । एविएटर गेम के विरोधाभास को समझाने के लिए सरल है ।
https://nikomixhousing.nikomix.vn/property/%e0%a4%a8%e0%a4%be%e0%a4%ae-%e0%a4%ae%e0%a5%87%e0%a4%82-%e0%a4%97%e0%a5%87%e0%a4%ae-%e0%a4%aa%e0%a4%b0-%e0%a4%a6%e0%a4%bf%e0%a4%b2-%e0%a4%ae%e0%a5%87%e0%a4%82-%e0%a4%b8%e0%a4%9f%e0%a5%8d%e0%a4%9f/
कॉल ब्रेक कार्ड गेम को लकड़ी या घोची भी कहा जाता है। इसमें खिलाड़ी दांव लगाते हैं और टेबल पर सबसे बड़े कार्ड से जीतना होता है। MPL पर free mein paisa kamane wala game जैसे क्लासिक, रैपिड, मल्टी-विनर, और ट्रंप कॉल ब्रेक गेम खेल कर पैसा कमा सकते हैं। कई लोग इस दिलचस्प प्रोजेक्ट के सही एल्गोरिदम के बारे में जानना चाहते हैं। गेम के काम करने के तरीके को समझने से आपको जोखिम और अवसरों की बेहतर समझ मिलती है। मूल रूप से, एक भरोसेमंद रैंडम नंबर जेनरेटर (RNG) सिस्टम गेम की नींव है, जो यह निर्धारित करता है कि राउंड किस ऊँचाई पर खत्म होगा।
online mexican pharmacies mail order pharmacy names cost of mounjaro in mexico
tredimin 50.000 prezzo farmacia online con ricetta medica progeffik 200 prezzo
comprar prep sin receta: optifast farmacia online – farmacia estrada online
comprar fluoxetina sin receta en espaГ±a opiniones farmacia online barata farmacia online telefono
canal farmacia online: Confia Pharma – lambdalina comprar sin receta
clobesol crema acquisto online Farmacia Subito online farmacia italiani
farmacia online nizza francia: migliore farmacia online 2021 – doricum gocce nasali prezzo
en compresse 2 mg prezzo enstilar schiuma prezzo ticket advantan crema prezzo
farmacia online melilla: dercutane comprar sin receta – farmacia online xl descuento
farmacia catalogo online farmacia online andorra viagra se puede comprar valium sin receta
where to buy generic clomiphene no prescription rx clomid how can i get generic clomid no prescription how can i get generic clomid without prescription get clomiphene without insurance cost of generic clomid pills cheap clomid pills
farmacia online 24365 comprar zolpidem sin receta la ampicilina se puede comprar sin receta
fluoresceine pharmacie sans ordonnance: tadalafil sans ordonnance en belgique Рm̩dicaments prostate sans ordonnance en pharmacie
venta de farmacia online Confia Pharma tromalyt 150 se puede comprar sin receta
equivalent viagra pharmacie sans ordonnance: ozempic sans ordonnance quГ©bec – surgam 200 sans ordonnance
peut on acheter des somnif̬re sans ordonnance en pharmacie: acheter viagra ou cialis Рgel douche mustela
http://confiapharma.com/# farmacia online adra
zirtec gocce bambini: chemicetina ovuli 500 – cipralex gocce prezzo
https://confiapharma.shop/# farmacia prezzi online
bentelan gatto: giant 20/5 – immudek forte bustine
donde comprar quetiapina sin receta: metronidazol 5oo mg se puede comprar sin receta medica en espaГ±a?? – farmacia online de zaragoza
cefixoral prezzo: Farmacia Subito – artrotec 75 prezzo
https://pharmacieexpress.com/# collier cervical pharmacie sans ordonnance
spasmex mal di pancia: enterolactis plus bugiardino – konakion fiale
xarenel 50.000 prezzo: mederma gel cicatrici – aulin prezzo
farmacia online dutasteride: Confia Pharma – surmenalit farmacia online
dermablend vichy 25: somnifГЁres sans ordonnance en pharmacie – test covid sans ordonnance pharmacie
acheter ventoline sans ordonnance en pharmacie: levitra sans ordonnance en pharmacie – creme emla sur ordonnance
zaldiar se puede comprar sin receta: comprar alopurinol sin receta – donde comprar ansiolГticos sin receta
miglior farmacia online 2023: Farmacia Subito – farmacia slovenia online
http://confiapharma.com/# comprar alopurinol sin receta
curso gestion oficina de farmacia online: puedo comprar cialis sin receta mГ©dica – puedo comprar metronidazol sin receta mГ©dica
zitromax sciroppo: meloxidyl cane – tadap 20 mg prezzo
lotion avene: lexomil sans ordonnance en pharmacie – renouvellement ordonnance sans consultation
https://pharmacieexpress.shop/# arsenicum album 15ch indication
omeprazolo prezzo senza ricetta: Farmacia Subito – cemisiana pillola prezzo
deltacortene prezzo senza ricetta: folifill 5 mg prezzo – migliore farmacia online forum
cefodox sciroppo: debridat 150 mg prezzo – tachidol 1000
https://farmaciasubito.shop/# punture pappataci come riconoscerle
acheter medicaments sans ordonnance: pharmacie en ligne sans ordonnance – Achat mГ©dicament en ligne fiable
pharmacie en ligne sans ordonnance: acheter medicaments sans ordonnance – vente de mГ©dicament en ligne
traitement ED discret en ligne: commander Cialis en ligne sans prescription – Acheter Cialis 20 mg pas cher
https://ciasansordonnance.shop/# pharmacie en ligne sans ordonnance
Acheter Cialis: commander Cialis en ligne sans prescription – Cialis sans ordonnance 24h
viagra en ligne: livraison rapide Viagra en France – livraison rapide Viagra en France
You can email the site owner to let them know you were blocked. Please include what you were doing when this page came up and the Cloudflare Ray ID found at the bottom of this page. Our company was registered with Suruhanjaya Syarikat Malaysia (SSM) on 2nd December 2015. We officially started operations on 1st April 2018 at Menara Mitraland, Kota Damansara through rental of an office space. Subsequently, we moved to our existing Centre and started operations equipped with training rooms on 1st April 2019. We are now in our 2nd year at our current Centre and LangIT is embarking on an active expansion phase . Slot gacor di Leoslot88 terkenal mudah dimainkan dan menawarkan tingkat kemenangan yang tinggi. Setiap game dirancang dengan grafis menarik dan fitur-fitur inovatif yang membuat pengalaman bermain semakin menghibur. Slot88, sebagai salah satu platform game slot online yang populer di Leoslot88, menawarkan berbagai permainan slot yang gampang menang, menjadikannya pilihan terbaik bagi para pemain yang ingin meningkatkan peluang kemenangan mereka.
https://frozenclub.in/instant-download-slot-ludos-tez-earning-app-with-professional-live-dealers/
iGaming News, Blog, and Bonus Specialist Manhattan Casino Slots begins with a welcome bonus for newbies, why not join the casino today and get a 100% match bonus for your first two deposits in playing Keno or Slots, you can win up to $747. You will be rewarded with a 100% match bonus in Table and Card games, this can make you win up to $150. The casino has always been straight with me. The one thing seriously lacking from this casino is any and all no deposit bonuses for depositing players. You either can play on a clean deposit and if you don’t win request cashback or play with a deposit bonus coupon and receive no cashback. Between deposits there aren’t any free spins or chips except if you make a deposit and use a code for free spins. ** Valid for DEPOSITORS Prayer Support Players from the USA are accepted at Manhattan Slots Casino.
viagra sans ordonnance: commander Viagra discretement – viagra en ligne
https://viasansordonnance.shop/# prix bas Viagra generique
Cialis sans ordonnance 24h: acheter Cialis sans ordonnance – cialis sans ordonnance
acheter Kamagra sans ordonnance: kamagra pas cher – livraison discrete Kamagra
http://kampascher.com/# Kamagra oral jelly pas cher
Viagra generique en pharmacie: Acheter du Viagra sans ordonnance – viagra sans ordonnance
prix bas Viagra generique: Meilleur Viagra sans ordonnance 24h – Meilleur Viagra sans ordonnance 24h
Viagra sans ordonnance 24h Acheter du Viagra sans ordonnance livraison rapide Viagra en France
kamagra en ligne: commander Kamagra en ligne – acheter kamagra site fiable
https://ciasansordonnance.com/# Cialis generique sans ordonnance
prix bas Viagra generique: Viagra generique en pharmacie – Viagra sans ordonnance 24h
Pharmacie sans ordonnance: Kamagra oral jelly pas cher – livraison discrete Kamagra
https://viasansordonnance.shop/# Viagra sans ordonnance 24h
Meilleur Viagra sans ordonnance 24h: livraison rapide Viagra en France – Meilleur Viagra sans ordonnance 24h
Acheter Cialis: Acheter Cialis 20 mg pas cher – cialis prix
pharmacie en ligne pas cher: acheter médicaments sans ordonnance – pharmacie en ligne fiable
https://viasansordonnance.com/# acheter Viagra sans ordonnance
Cialis generique sans ordonnance: Acheter Cialis 20 mg pas cher – Cialis sans ordonnance 24h
traitement ED discret en ligne: commander Cialis en ligne sans prescription – Acheter Cialis 20 mg pas cher
pharmacie en ligne sans prescription: commander sans consultation medicale – vente de mГ©dicament en ligne
Viagra sans ordonnance 24h: Viagra générique en pharmacie – viagra en ligne
https://viasansordonnance.com/# acheter Viagra sans ordonnance
pharmacie en ligne sans ordonnance: acheter medicaments sans ordonnance – pharmacie en ligne france fiable
kamagra livraison 24h: kamagra 100mg prix – kamagra en ligne
kamagra oral jelly: kamagra gel – acheter Kamagra sans ordonnance
Viagra sans ordonnance 24h: acheter Viagra sans ordonnance – commander Viagra discretement
https://ciasansordonnance.shop/# Acheter Cialis
acheter Viagra sans ordonnance: acheter Viagra sans ordonnance – Viagra generique en pharmacie
traitement ED discret en ligne: pharmacie en ligne livraison europe – traitement ED discret en ligne
Viagra générique en pharmacie: commander Viagra discretement – prix bas Viagra générique
pharmacie en ligne: acheter medicaments sans ordonnance – pharmacie en ligne
Meilleur Viagra sans ordonnance 24h: Viagra sans ordonnance 24h – livraison rapide Viagra en France
https://ciasansordonnance.com/# Cialis pas cher livraison rapide
Cialis sans ordonnance 24h: cialis generique – traitement ED discret en ligne
kamagra en ligne: kamagra oral jelly – acheter Kamagra sans ordonnance
livraison discrete Kamagra: acheter kamagra site fiable – Kamagra oral jelly pas cher
pharmacie en ligne france livraison belgique: acheter Kamagra sans ordonnance – acheter Kamagra sans ordonnance
https://kampascher.shop/# kamagra livraison 24h
Cialis generique sans ordonnance: Cialis generique sans ordonnance – Acheter Cialis 20 mg pas cher
cialis generique: acheter Cialis sans ordonnance – Acheter Cialis
Meilleur Viagra sans ordonnance 24h: Meilleur Viagra sans ordonnance 24h – Meilleur Viagra sans ordonnance 24h
Acheter Cialis: cialis generique Рtrouver un m̩dicament en pharmacie
https://ciasansordonnance.shop/# cialis generique
Ero Pharm Fast: where can i buy ed pills – Ero Pharm Fast
Online medication store Australia: PharmAu24 – Medications online Australia
https://eropharmfast.shop/# Ero Pharm Fast
antibiotic without presription: BiotPharm – buy antibiotics
Over the counter antibiotics pills: BiotPharm – cheapest antibiotics
https://pharmau24.com/# Discount pharmacy Australia
Buy medicine online Australia: Discount pharmacy Australia – Licensed online pharmacy AU
Ero Pharm Fast: ed doctor online – ed meds on line
PharmAu24: Licensed online pharmacy AU – pharmacy online australia
http://biotpharm.com/# buy antibiotics over the counter
Ero Pharm Fast: Ero Pharm Fast – low cost ed meds
Discount pharmacy Australia: Discount pharmacy Australia – Online medication store Australia
http://biotpharm.com/# buy antibiotics over the counter
https://pharmau24.shop/# pharmacy online australia
antibiotic without presription: BiotPharm – antibiotic without presription
Ero Pharm Fast: Ero Pharm Fast – ed online prescription
buy antibiotics buy antibiotics online uk buy antibiotics
order ed pills: Ero Pharm Fast – ed prescription online
PharmAu24: pharmacy online australia – Pharm Au24
http://biotpharm.com/# Over the counter antibiotics pills
ed medicines: low cost ed meds – Ero Pharm Fast
online pharmacy australia pharmacy online australia Medications online Australia
pharmacy online australia: Pharm Au 24 – online pharmacy australia
Discount pharmacy Australia: PharmAu24 – PharmAu24
Buy medicine online Australia: Medications online Australia – Online drugstore Australia
https://biotpharm.shop/# cheapest antibiotics
best online doctor for antibiotics: get antibiotics quickly – buy antibiotics
cheap ed medication: discount ed pills – buy ed pills
Online medication store Australia Pharm Au24 Online medication store Australia
antibiotic without presription: BiotPharm – buy antibiotics over the counter
https://biotpharm.shop/# buy antibiotics for uti
cheap ed erectile dysfunction drugs online Ero Pharm Fast
Discount pharmacy Australia: online pharmacy australia – Buy medicine online Australia
online pharmacy australia: PharmAu24 – online pharmacy australia
Online drugstore Australia Online drugstore Australia pharmacy online australia
Over the counter antibiotics for infection: over the counter antibiotics – get antibiotics quickly
purchase cialis online cheap: online tadalafil – evolution peptides tadalafil
cialis 20 mg best price Tadal Access cialis dosis
https://tadalaccess.com/# how long i have to wait to take tadalafil after antifugal
cialis 5mg coupon Tadal Access cheaper alternative to cialis
https://tadalaccess.com/# when will generic tadalafil be available
cheap cialis pills: Tadal Access – cialis price walmart
cialis dopoxetine stendra vs cialis cialis priligy online australia
cialis soft: buying cialis generic – cialis professional review
buy cheap tadalafil online what to do when cialis stops working cialis 20 milligram
cialis bodybuilding: how long does it take cialis to start working – cialis canada price
https://tadalaccess.com/# tadalafil review forum
cialis wikipedia: Tadal Access – mambo 36 tadalafil 20 mg
cialis otc 2016 TadalAccess tadalafil oral jelly
https://tadalaccess.com/# cost of cialis for daily use
where to buy cialis over the counter: cialis available in walgreens over counter?? – cialis com coupons
difference between cialis and tadalafil where can i buy cialis tadalafil tablets 20 mg reviews
us pharmacy prices for cialis: when does cialis patent expire – over the counter drug that works like cialis
https://tadalaccess.com/# over the counter cialis 2017
no prescription female cialis: cialis 20mg side effects – cialis at canadian pharmacy
blue sky peptide tadalafil review TadalAccess cialis professional
cialis where can i buy: pharmacy 365 cialis – how to take liquid tadalafil
https://tadalaccess.com/# cialis online without a prescription
cialis over the counter usa: TadalAccess – cialis generic online
maximpeptide tadalafil review is cialis a controlled substance cialis canada price
https://tadalaccess.com/# what is cialis tadalafil used for
cialis 10mg reviews cialis daily dosage tadalafil 40 mg india
cialis recreational use: TadalAccess – cialis delivery held at customs
cialis 20 mg how long does it take to work: Tadal Access – brand cialis with prescription
tadalafil review forum Tadal Access canada cialis for sale
https://tadalaccess.com/# price of cialis at walmart
over the counter cialis: TadalAccess – what does generic cialis look like
cialis max dose: Tadal Access – cialis for daily use side effects
how much does cialis cost per pill cialis generic generic tadalafil cost
https://tadalaccess.com/# generic tadalafil canada
tadalafil online canadian pharmacy: cialis erection – where can i buy cialis over the counter
natural alternative to cialis TadalAccess cialis blood pressure
https://tadalaccess.com/# cialis generic cvs
cialis free trial voucher: Tadal Access – tadalafil tamsulosin combination
is cialis covered by insurance: natural cialis – tadalafil online canadian pharmacy
buy cialis with american express TadalAccess oryginal cialis
https://tadalaccess.com/# generic cialis tadalafil 20mg reviews
cialis 5 mg tablet: cialis 10mg – cialis contraindications
walmart cialis price: Tadal Access – cialis for performance anxiety
mint pharmaceuticals tadalafil Tadal Access cialis coupon rite aid
https://tadalaccess.com/# buying cialis in canada
natural alternative to cialis: Tadal Access – tadalafil 20mg (generic equivalent to cialis)
how long before sex should you take cialis: tadalafil (tadalis-ajanta) – pictures of cialis pills
https://tadalaccess.com/# generic cialis tadalafil 20mg india
cialis for daily use cost: TadalAccess – cialis w/dapoxetine
where to buy liquid cialis TadalAccess cialis liquid for sale
sanofi cialis: Tadal Access – cheap cialis pills
https://tadalaccess.com/# when does cialis go generic
cialis 5 mg tablet: TadalAccess – which is better cialis or levitra
tadalafil no prescription forum Tadal Access cialis online no prescription australia
https://tadalaccess.com/# cialis tablets for sell
cialis drug class: cialis overnight deleivery – buy tadalafil online no prescription
no presciption cialis buy cialis online in austalia what happens if a woman takes cialis
sublingual cialis: originalcialis – cialis india
https://tadalaccess.com/# compounded tadalafil troche life span
prices of cialis: Tadal Access – cialis dosages
how much does cialis cost at walmart Tadal Access when does cialis patent expire
generic cialis 20 mg from india: brand cialis australia – recreational cialis
https://tadalaccess.com/# san antonio cialis doctor
buy tadalafil online paypal: where to buy tadalafil in singapore – special sales on cialis
best price on generic tadalafil Tadal Access cialis online no prior prescription
buy cialis online reddit: Tadal Access – generic cialis
https://tadalaccess.com/# п»їwhat can i take to enhance cialis
tadalafil 20mg: TadalAccess – cialis over the counter in spain
buy cialis no prescription overnight TadalAccess price comparison tadalafil
https://tadalaccess.com/# letairis and tadalafil
mambo 36 tadalafil 20 mg reviews: cialis sample request form – cialis from canada to usa
cialis and blood pressure: cialis online paypal – generic tadalafil canada
https://tadalaccess.com/# generic cialis available in canada
cialis black review: cialis sample – buy cialis overnight shipping
pastilla cialis cialis black tadalafil vs cialis
https://tadalaccess.com/# canadian pharmacy generic cialis
buy tadalafil cheap online cialis in canada cialis testimonials
what is the active ingredient in cialis: Tadal Access – how to buy tadalafil online
https://tadalaccess.com/# originalcialis
tadalafil 20 mg directions: TadalAccess – us cialis online pharmacy
cialis manufacturer coupon 2018: TadalAccess – paypal cialis payment
cialis with out a prescription cialis purchase cialis side effects heart
https://tadalaccess.com/# order generic cialis online
buy generic cialiss: buy cialis online no prescription – buy tadalafil online canada
canadian pharmacy cialis: tadalafil without a doctor prescription – tadalafil citrate powder
https://tadalaccess.com/# cost of cialis for daily use
cialis by mail how much does cialis cost at walmart cialis 5 mg
when to take cialis 20mg: cialis medicare – cialis experience
can you drink alcohol with cialis: TadalAccess – taking cialis
https://tadalaccess.com/# cialis tablets
mambo 36 tadalafil 20 mg Tadal Access best reviewed tadalafil site
buy cialis no prescription: best price on cialis – cialis overnight shipping
cialis advertisement: bph treatment cialis – how to buy cialis
cialis alternative over the counter Tadal Access cialis at canadian pharmacy
cialis contraindications: how long does cialis take to work 10mg – tadalafil 5 mg tablet
https://tadalaccess.com/# how to get cialis prescription online
generic tadalafil prices: TadalAccess – cialis one a day with dapoxetine canada
cialis overnight deleivery Tadal Access how much does cialis cost at walgreens
cialis manufacturer coupon: overnight cialis delivery – overnight cialis delivery
https://tadalaccess.com/# cialis bodybuilding
cialis online usa: cialis vs flomax for bph – cialis directions
cialis max dose cialis and nitrates cialis free trial
cialis without a doctor prescription canada: cialis substitute – can you drink alcohol with cialis
https://tadalaccess.com/# is there a generic cialis available in the us
generic cialis vs brand cialis reviews: TadalAccess – generic cialis tadalafil 20 mg from india
cialis usa TadalAccess cialis 100mg review
cialis and adderall: sildenafil vs tadalafil which is better – cialis daily dose
https://tadalaccess.com/# cialis dopoxetine
cialis substitute: cialis mit paypal bezahlen – cialis coupon 2019
cialis going generic: cialis effects – sanofi cialis otc
cialis online reviews Tadal Access buy tadalafil online canada
https://tadalaccess.com/# cialis generic overnite shipping
buy generic cialiss: Tadal Access – cialis free trial voucher
tadalafil vidalista: reddit cialis – overnight cialis
whats the max safe dose of tadalafil xtenda for a healthy man TadalAccess cialis for enlarged prostate
https://tadalaccess.com/# tadalafil (tadalis-ajanta) reviews
cialis overdose: cialis tadalafil 20mg tablets – best time to take cialis
adcirca tadalafil: how to buy tadalafil – cialis reddit
cialis with dapoxetine TadalAccess ordering tadalafil online
https://tadalaccess.com/# where to get generic cialis without prescription
paypal cialis payment: TadalAccess – cialis slogan
buy tadalafil cheap online: cialis not working first time – tamsulosin vs. tadalafil
https://tadalaccess.com/# cialis samples for physicians
cheap cialis online overnight shipping buy cialis online australia pay with paypal cialis dosage side effects
generic tadalafil 40 mg: cialis buy online canada – buy cialis with dapoxetine in canada
brand cialis: cialis for daily use cost – taking cialis
https://tadalaccess.com/# u.s. pharmacy prices for cialis
cialis website uses for cialis tadalafil online paypal
tadalafil cheapest price: Tadal Access – where can i get cialis
trusted online store to buy cialis: TadalAccess – cialis used for
cialis directions TadalAccess cialis free trial canada
whats cialis: Tadal Access – canada pharmacy cialis
cialis online cheap: cialis recreational use – too much cialis
https://tadalaccess.com/# para que sirve las tabletas cialis tadalafil de 5mg
maximpeptide tadalafil review TadalAccess cialis overnight deleivery
original cialis online: what does cialis look like – when does cialis patent expire
how long does it take for cialis to take effect: overnight cialis – free samples of cialis
https://tadalaccess.com/# cialis dosage for bph
cialis canadian pharmacy Tadal Access cheap cialis online overnight shipping
cialis side effects heart: cialis for enlarged prostate – how long does cialis take to work
cialis super active reviews: cialis tadalafil 5mg once a day – purchase cialis on line
https://tadalaccess.com/# cialis insurance coverage blue cross
cialis prescription assistance program: cialis 10mg price – tadalafil generic in usa
cialis 20 mg best price cialis cheapest prices india pharmacy cialis
evolution peptides tadalafil: cialis generic name – buying cialis online
Amo Health Care: Amo Health Care – amoxicillin over the counter in canada
https://clomhealth.shop/# can i purchase generic clomid online
amoxicillin buy online canada: Amo Health Care – Amo Health Care
PredniHealth PredniHealth PredniHealth
order prednisone: steroids prednisone for sale – how to buy prednisone online
Amo Health Care: Amo Health Care – Amo Health Care
amoxicillin over counter Amo Health Care Amo Health Care
where can i buy clomid for sale: where to get cheap clomid without a prescription – buy cheap clomid price
https://amohealthcare.store/# Amo Health Care
Amo Health Care: amoxicillin buy canada – order amoxicillin 500mg
Amo Health Care Amo Health Care Amo Health Care
buy prednisone online without a script: prednisone 20mg capsule – PredniHealth
https://amohealthcare.store/# Amo Health Care
prednisone 20 mg: PredniHealth – PredniHealth
PredniHealth: PredniHealth – prednisone without prescription 10mg
how to get clomid for sale: can you get generic clomid for sale – where buy generic clomid without a prescription
https://prednihealth.shop/# PredniHealth
Amo Health Care: amoxicillin online purchase – Amo Health Care
amoxicillin 500mg no prescription: ampicillin amoxicillin – generic amoxil 500 mg
http://prednihealth.com/# PredniHealth
how can i get cheap clomid online Clom Health how to buy clomid
can i get clomid prices: where to get generic clomid online – can you get clomid now
order amoxicillin uk: Amo Health Care – Amo Health Care
prednisone 20mg tablets where to buy: PredniHealth – PredniHealth
https://amohealthcare.store/# amoxicillin 500 mg without prescription
buy cheap clomid price: Clom Health – how can i get cheap clomid no prescription
PredniHealth PredniHealth prednisone 50 mg canada
generic amoxicillin cost: amoxicillin online purchase – Amo Health Care
clomid sale: where to buy cheap clomid online – can you get generic clomid without rx
20 mg prednisone tablet: prednisone 5 mg cheapest – prednisone 10 tablet
https://amohealthcare.store/# generic amoxicillin
Amo Health Care amoxicillin 775 mg amoxicillin brand name
Modafinil for sale: modafinil 2025 – verified Modafinil vendors
https://zipgenericmd.shop/# cheap Cialis online
online Cialis pharmacy: reliable online pharmacy Cialis – best price Cialis tablets
cheap Cialis online affordable ED medication discreet shipping ED pills
fast Viagra delivery: no doctor visit required – Viagra without prescription
modafinil 2025: purchase Modafinil without prescription – doctor-reviewed advice
legal Modafinil purchase: buy modafinil online – buy modafinil online
http://maxviagramd.com/# discreet shipping
legit Viagra online same-day Viagra shipping cheap Viagra online
legal Modafinil purchase: Modafinil for sale – modafinil 2025
legal Modafinil purchase: doctor-reviewed advice – modafinil pharmacy
best price Cialis tablets: discreet shipping ED pills – order Cialis online no prescription
purchase Modafinil without prescription doctor-reviewed advice verified Modafinil vendors
Modafinil for sale: verified Modafinil vendors – purchase Modafinil without prescription
modafinil 2025: modafinil pharmacy – Modafinil for sale
legal Modafinil purchase: doctor-reviewed advice – Modafinil for sale
http://modafinilmd.store/# modafinil legality
order Viagra discreetly trusted Viagra suppliers order Viagra discreetly
safe online pharmacy: same-day Viagra shipping – no doctor visit required
modafinil pharmacy: safe modafinil purchase – legal Modafinil purchase
same-day Viagra shipping: safe online pharmacy – fast Viagra delivery
best price Cialis tablets generic tadalafil cheap Cialis online
fast Viagra delivery: buy generic Viagra online – Viagra without prescription
order Cialis online no prescription: secure checkout ED drugs – Cialis without prescription
http://zipgenericmd.com/# order Cialis online no prescription
Cialis without prescription: best price Cialis tablets – generic tadalafil
discreet shipping: trusted Viagra suppliers – same-day Viagra shipping
safe online pharmacy order Viagra discreetly best price for Viagra
verified Modafinil vendors: buy modafinil online – modafinil 2025
https://modafinilmd.store/# Modafinil for sale
same-day Viagra shipping: buy generic Viagra online – order Viagra discreetly
generic sildenafil 100mg trusted Viagra suppliers order Viagra discreetly
generic sildenafil 100mg: best price for Viagra – trusted Viagra suppliers
reliable online pharmacy Cialis: order Cialis online no prescription – buy generic Cialis online
cheap Viagra online: buy generic Viagra online – buy generic Viagra online
https://zipgenericmd.com/# best price Cialis tablets
modafinil legality Modafinil for sale modafinil 2025
cheap Cialis online: order Cialis online no prescription – secure checkout ED drugs
order Cialis online no prescription: order Cialis online no prescription – FDA approved generic Cialis
order Viagra discreetly: best price for Viagra – cheap Viagra online
Can you be more specific about the content of your article? After reading it, I still have some doubts. Hope you can help me.
legal Modafinil purchase modafinil legality verified Modafinil vendors
secure checkout Viagra trusted Viagra suppliers buy generic Viagra online
affordable ED medication: generic tadalafil – online Cialis pharmacy
purchase Modafinil without prescription: modafinil legality – legal Modafinil purchase
https://modafinilmd.store/# modafinil 2025
generic sildenafil 100mg: generic sildenafil 100mg – cheap Viagra online
online Cialis pharmacy: buy generic Cialis online – order Cialis online no prescription
order Viagra discreetly order Viagra discreetly same-day Viagra shipping
verified Modafinil vendors: modafinil 2025 – buy modafinil online
Cialis without prescription: order Cialis online no prescription – best price Cialis tablets
best price Cialis tablets: Cialis without prescription – reliable online pharmacy Cialis
http://modafinilmd.store/# verified Modafinil vendors
modafinil 2025: purchase Modafinil without prescription – legal Modafinil purchase
modafinil legality safe modafinil purchase purchase Modafinil without prescription
no doctor visit required: no doctor visit required – fast Viagra delivery
modafinil legality: purchase Modafinil without prescription – modafinil legality
https://zipgenericmd.com/# buy generic Cialis online
secure checkout ED drugs: generic tadalafil – FDA approved generic Cialis
best price Cialis tablets generic tadalafil best price Cialis tablets
пин ап зеркало: пин ап казино официальный сайт – pin up вход
http://pinuprus.pro/# пин ап казино официальный сайт
pin up az: pin up az – pin-up
vavada вавада vavada casino
pin up azerbaycan: pin up – pin up
http://pinupaz.top/# pin up casino
вавада казино: vavada casino – вавада
вавада казино вавада официальный сайт vavada
pin up az: pin up – pin-up
http://pinupaz.top/# pin up
пинап казино: пин ап казино официальный сайт – pin up вход
пин ап зеркало: пин ап казино официальный сайт – пинап казино
pin-up: pinup az – pin up
https://vavadavhod.tech/# вавада зеркало
vavada вход vavada вход vavada casino
pin-up: pin up casino – pin up
pin up azerbaycan: pin up az – pin up azerbaycan
http://pinupaz.top/# pin-up casino giris
pin up az: pinup az – pin-up casino giris
пинап казино pin up вход пин ап казино официальный сайт
vavada вход: vavada – вавада казино
http://pinupaz.top/# pin up
pin up az: pinup az – pin-up casino giris
pin-up casino giris pin up az pin-up casino giris
пинап казино: пин ап казино – пинап казино
https://pinuprus.pro/# пин ап казино официальный сайт
pinup az: pin up – pin up azerbaycan
pin up pinup az pin up
пин ап зеркало: пин ап казино официальный сайт – пин ап зеркало
пин ап казино официальный сайт: пин ап вход – пин ап казино
пин ап казино пин ап казино пин ап вход
pin-up casino giris: pin-up – pin up casino
https://pinupaz.top/# pin up azerbaycan
пин ап казино: pin up вход – пин ап казино официальный сайт
пин ап вход пин ап зеркало пин ап вход
вавада официальный сайт: vavada – вавада зеркало
http://vavadavhod.tech/# вавада зеркало
pin-up: pin up casino – pin-up
pin up casino: pin up az – pin up azerbaycan
pin-up casino giris pin-up pin-up casino giris
https://pinupaz.top/# pin up casino
вавада официальный сайт: vavada – vavada
пин ап казино официальный сайт: pin up вход – пинап казино
пин ап зеркало pin up вход pin up вход
http://pinuprus.pro/# пин ап казино официальный сайт
pin up az: pinup az – pinup az
вавада официальный сайт: вавада зеркало – вавада официальный сайт
pinup az pin up azerbaycan pin up casino
http://pinuprus.pro/# pin up вход
vavada: вавада казино – vavada вход
вавада зеркало: vavada вход – вавада казино
pin-up pin up casino pin up az
https://pinupaz.top/# pin-up
vavada: вавада казино – вавада
вавада официальный сайт: vavada вход – вавада официальный сайт
https://vavadavhod.tech/# вавада официальный сайт
вавада казино вавада официальный сайт вавада зеркало
пин ап зеркало: pin up вход – пин ап казино официальный сайт
pin up вход: пин ап вход – пин ап зеркало
https://pinupaz.top/# pinup az
pin-up pin up azerbaycan pin up casino
вавада официальный сайт: вавада казино – вавада казино
http://pinuprus.pro/# пинап казино
вавада зеркало: вавада казино – вавада зеркало
pin-up pinup az pin up
pin-up casino giris: pin up azerbaycan – pin up az
http://vavadavhod.tech/# вавада казино
pin up azerbaycan: pin up az – pin up azerbaycan
пин ап казино официальный сайт: пин ап казино – пин ап вход
вавада официальный сайт vavada casino вавада
https://pinuprus.pro/# пин ап зеркало
pin up: pin-up casino giris – pin up casino
пин ап зеркало: пин ап зеркало – pin up вход
vavada вавада зеркало вавада зеркало
http://pinuprus.pro/# пинап казино
pin up вход: pin up вход – пинап казино
pin up azerbaycan: pin-up – pin up azerbaycan
vavada vavada вход вавада официальный сайт
https://vavadavhod.tech/# vavada casino
pin up casino: pinup az – pin up az
пин ап зеркало: пин ап казино – пин ап казино официальный сайт
пин ап казино официальный сайт pin up вход пин ап вход
https://pinupaz.top/# pin up az
пин ап вход: пин ап казино – пин ап казино официальный сайт
pin up вход: pin up вход – пин ап вход
pin-up casino giris pin up azerbaycan pin up casino
https://pinupaz.top/# pin up casino
пин ап казино официальный сайт: пин ап казино официальный сайт – пин ап зеркало
пин ап зеркало: пинап казино – пин ап казино официальный сайт
пин ап вход pin up вход пинап казино
http://pinuprus.pro/# пин ап вход
вавада официальный сайт: вавада официальный сайт – вавада казино
pin up: pin up az – pin up
https://pinuprus.pro/# пинап казино
pin up pinup az pin up
pin up az: pin up azerbaycan – pin up
http://pinuprus.pro/# пин ап зеркало
пинап казино: пинап казино – пин ап зеркало
пинап казино пин ап вход пинап казино
vavada casino: вавада официальный сайт – вавада зеркало
vavada: vavada casino – vavada вход
https://pinuprus.pro/# pin up вход
pin up: pin up casino – pinup az
вавада официальный сайт: vavada вход – вавада
vavada casino вавада вавада зеркало
вавада официальный сайт: vavada – вавада
http://vavadavhod.tech/# вавада
pin-up: pin-up casino giris – pin up casino
vavada вавада официальный сайт вавада зеркало
pinup az: pin up – pinup az
http://pinuprus.pro/# пин ап казино
пин ап зеркало: pin up вход – пин ап казино
pinup az: pin up azerbaycan – pin up az
пин ап зеркало пин ап казино официальный сайт пин ап казино официальный сайт
пин ап вход: пин ап вход – пин ап казино
вавада официальный сайт: vavada casino – вавада зеркало
pin up az: pin up casino – pin up az
vavada вавада vavada
пин ап казино: пин ап вход – пин ап зеркало
https://vavadavhod.tech/# vavada вход
вавада официальный сайт: вавада – vavada casino
vavada вход: вавада казино – vavada casino
пин ап вход: пин ап вход – pin up вход
вавада vavada casino vavada
https://vavadavhod.tech/# vavada casino
vavada casino: вавада зеркало – vavada casino
vavada: вавада официальный сайт – вавада
vavada: vavada – vavada casino
pinup az pin-up casino giris pinup az
http://pinupaz.top/# pin up az
пин ап казино официальный сайт: пин ап казино – pin up вход
вавада казино: вавада зеркало – vavada
пин ап казино: pin up вход – пин ап вход
вавада зеркало vavada вавада официальный сайт
http://vavadavhod.tech/# вавада зеркало
pin up azerbaycan: pinup az – pin up
pin up az: pin up casino – pin-up
http://vavadavhod.tech/# вавада
пин ап казино официальный сайт: пин ап казино официальный сайт – пин ап вход
вавада казино vavada casino vavada вход
pin-up casino giris: pin-up casino giris – pin up azerbaycan
pin up: pinup az – pin up
https://pinupaz.top/# pin up
вавада зеркало: вавада казино – вавада
pin up casino pin up pin up casino
vavada casino: вавада казино – вавада казино
vavada: вавада официальный сайт – vavada casino
https://pinupaz.top/# pin-up
vavada casino вавада зеркало vavada casino
пинап казино: пин ап казино – пин ап казино
pin-up casino giris: pinup az – pin up az
https://pinuprus.pro/# пинап казино
пин ап казино pin up вход пин ап казино официальный сайт
пин ап казино: пин ап казино – pin up вход
pin up вход: пин ап казино официальный сайт – пин ап вход
https://vavadavhod.tech/# вавада казино
pin-up casino giris: pin-up casino giris – pin up
vavada вход вавада вавада
пин ап казино официальный сайт: пин ап вход – pin up вход
http://pinuprus.pro/# пин ап вход
mexico drug stores pharmacies: mexican online pharmacy – medication from mexico pharmacy
indian pharmacy online shopping: medicine courier from India to USA – Medicine From India
medicine courier from India to USA Medicine From India indianpharmacy com
buying prescription drugs in mexico online: mexico pharmacies prescription drugs – buying from online mexican pharmacy
mexican online pharmacy: mexican online pharmacy – mexican online pharmacy
medicine courier from India to USA indian pharmacy online Medicine From India
mexico drug stores pharmacies: mexico pharmacy order online – RxExpressMexico
https://rxexpressmexico.com/# mexico pharmacies prescription drugs
MedicineFromIndia: medicine courier from India to USA – medicine courier from India to USA
indian pharmacy online: indian pharmacy online – indian pharmacy online
indian pharmacy: indian pharmacy – indian pharmacy
https://medicinefromindia.com/# buy prescription drugs from india
mexican online pharmacy Rx Express Mexico mexico pharmacies prescription drugs
mexican mail order pharmacies: mexican rx online – Rx Express Mexico
Rx Express Mexico: mexico pharmacy order online – mexico pharmacy order online
mexican online pharmacy: mexican online pharmacy – mexico pharmacies prescription drugs
http://expressrxcanada.com/# prescription drugs canada buy online
Rx Express Mexico: Rx Express Mexico – Rx Express Mexico
RxExpressMexico Rx Express Mexico mexico pharmacies prescription drugs
MedicineFromIndia: indian pharmacy online – indian pharmacy online
online canadian drugstore: Canadian pharmacy shipping to USA – canadian pharmacy ed medications
RxExpressMexico: RxExpressMexico – Rx Express Mexico
https://rxexpressmexico.shop/# mexico drug stores pharmacies
indian pharmacy online shopping indian pharmacy medicine courier from India to USA
Medicine From India: Medicine From India – indian pharmacy online shopping
mexico drug stores pharmacies: mexican rx online – mexico pharmacies prescription drugs
http://medicinefromindia.com/# Medicine From India
canadian pharmacy uk delivery: Express Rx Canada – adderall canadian pharmacy
reputable indian online pharmacy MedicineFromIndia MedicineFromIndia
canadian discount pharmacy: Express Rx Canada – canadian pharmacy in canada
mexico pharmacies prescription drugs: mexican rx online – Rx Express Mexico
https://rxexpressmexico.shop/# Rx Express Mexico
Rx Express Mexico: mexican pharmaceuticals online – mexico pharmacies prescription drugs
indian pharmacy indian pharmacy online indian pharmacy
mexico drug stores pharmacies: mexican online pharmacy – Rx Express Mexico
mexico pharmacy order online: RxExpressMexico – mexico drug stores pharmacies
http://medicinefromindia.com/# Medicine From India
canadian pharmacy ed medications: Buy medicine from Canada – safe reliable canadian pharmacy
kamagra en ligne kamagra oral jelly kamagra gel
п»їpharmacie en ligne france: pharmacie en ligne sans ordonnance – pharmacie en ligne sans ordonnance pharmafst.com
https://tadalmed.shop/# Tadalafil sans ordonnance en ligne
Cialis generique prix: cialis prix – Acheter Cialis 20 mg pas cher tadalmed.shop
Kamagra Oral Jelly pas cher: Kamagra pharmacie en ligne – Kamagra pharmacie en ligne
Tadalafil 20 mg prix sans ordonnance cialis prix Tadalafil 20 mg prix sans ordonnance tadalmed.com
https://pharmafst.com/# pharmacie en ligne fiable
https://pharmafst.shop/# acheter mГ©dicament en ligne sans ordonnance
http://tadalmed.com/# Cialis sans ordonnance pas cher
http://kamagraprix.com/# kamagra 100mg prix
https://tadalmed.com/# Tadalafil 20 mg prix en pharmacie
kamagra 100mg prix: kamagra en ligne – Kamagra Oral Jelly pas cher
kamagra livraison 24h: Kamagra Commander maintenant – kamagra gel
vente de mГ©dicament en ligne: Pharmacies en ligne certifiees – п»їpharmacie en ligne france pharmafst.com
https://pharmafst.com/# pharmacies en ligne certifiГ©es
Acheter Viagra Cialis sans ordonnance: Acheter Cialis – Cialis sans ordonnance 24h tadalmed.shop
Acheter Cialis: Tadalafil sans ordonnance en ligne – Cialis en ligne tadalmed.shop
Pharmacie en ligne Cialis sans ordonnance: Cialis sans ordonnance 24h – Tadalafil 20 mg prix sans ordonnance tadalmed.shop
Kamagra Oral Jelly pas cher kamagra pas cher Acheter Kamagra site fiable
http://kamagraprix.com/# Achetez vos kamagra medicaments
Cialis sans ordonnance 24h: Cialis sans ordonnance pas cher – Cialis sans ordonnance 24h tadalmed.shop
Cialis sans ordonnance pas cher: Tadalafil sans ordonnance en ligne – cialis prix tadalmed.shop
pharmacie en ligne sans ordonnance: Meilleure pharmacie en ligne – pharmacie en ligne fiable pharmafst.com
Kamagra Oral Jelly pas cher Kamagra pharmacie en ligne kamagra en ligne
http://tadalmed.com/# Achat Cialis en ligne fiable
Achetez vos kamagra medicaments: kamagra oral jelly – Achetez vos kamagra medicaments
kamagra en ligne: Acheter Kamagra site fiable – kamagra en ligne
https://pharmafst.com/# pharmacie en ligne france livraison belgique
kamagra livraison 24h kamagra 100mg prix kamagra livraison 24h
acheter mГ©dicament en ligne sans ordonnance: Medicaments en ligne livres en 24h – Pharmacie Internationale en ligne pharmafst.com
kamagra livraison 24h: acheter kamagra site fiable – Achetez vos kamagra medicaments
https://kamagraprix.shop/# kamagra pas cher
Acheter Kamagra site fiable achat kamagra kamagra en ligne
Cialis sans ordonnance 24h: Acheter Cialis – Cialis en ligne tadalmed.shop
https://kamagraprix.shop/# kamagra en ligne
trouver un mГ©dicament en pharmacie Pharmacie en ligne France pharmacie en ligne france pas cher pharmafst.shop
acheter mГ©dicament en ligne sans ordonnance: Pharmacies en ligne certifiees – pharmacie en ligne livraison europe pharmafst.com
acheter mГ©dicament en ligne sans ordonnance: Livraison rapide – pharmacies en ligne certifiГ©es pharmafst.com
http://pharmafst.com/# п»їpharmacie en ligne france
Acheter Kamagra site fiable kamagra 100mg prix kamagra livraison 24h
pharmacie en ligne pas cher: pharmacie en ligne sans ordonnance – pharmacie en ligne livraison europe pharmafst.com
kamagra gel: kamagra gel – kamagra livraison 24h
pharmacie en ligne france fiable: Livraison rapide – п»їpharmacie en ligne france pharmafst.com
https://kamagraprix.shop/# Kamagra Commander maintenant
Kamagra pharmacie en ligne: achat kamagra – Acheter Kamagra site fiable
Achetez vos kamagra medicaments Kamagra Oral Jelly pas cher Kamagra Commander maintenant
Achat mГ©dicament en ligne fiable: Medicaments en ligne livres en 24h – pharmacie en ligne avec ordonnance pharmafst.com
https://pharmafst.com/# vente de mГ©dicament en ligne
pharmacie en ligne sans ordonnance: Pharmacie en ligne livraison Europe – pharmacie en ligne pas cher pharmafst.com
Achat Cialis en ligne fiable Acheter Cialis Pharmacie en ligne Cialis sans ordonnance tadalmed.com
Pharmacie Internationale en ligne: Pharmacie Internationale en ligne – Pharmacie en ligne livraison Europe pharmafst.com
https://tadalmed.com/# Pharmacie en ligne Cialis sans ordonnance
pharmacie en ligne france fiable: pharmacie en ligne – trouver un mГ©dicament en pharmacie pharmafst.com
Cialis sans ordonnance 24h Acheter Cialis Pharmacie en ligne Cialis sans ordonnance tadalmed.com
http://pharmafst.com/# pharmacie en ligne avec ordonnance
Cialis sans ordonnance 24h: Tadalafil 20 mg prix en pharmacie – Cialis generique prix tadalmed.shop
Kamagra pharmacie en ligne: acheter kamagra site fiable – kamagra en ligne
Pharmacie Internationale en ligne trouver un mГ©dicament en pharmacie pharmacie en ligne sans ordonnance pharmafst.shop
https://tadalmed.shop/# Cialis sans ordonnance pas cher
Kamagra pharmacie en ligne: kamagra gel – kamagra oral jelly
acheter mГ©dicament en ligne sans ordonnance: Pharmacie en ligne France – pharmacie en ligne france livraison belgique pharmafst.com
cialis prix cialis prix Acheter Cialis 20 mg pas cher tadalmed.com
https://pharmafst.shop/# Pharmacie en ligne livraison Europe
acheter kamagra site fiable: Kamagra Oral Jelly pas cher – Achetez vos kamagra medicaments
Acheter Viagra Cialis sans ordonnance: cialis prix – Cialis sans ordonnance pas cher tadalmed.shop
pharmacie en ligne livraison europe Medicaments en ligne livres en 24h pharmacie en ligne fiable pharmafst.shop
http://pharmafst.com/# trouver un mГ©dicament en pharmacie
kamagra en ligne: Kamagra Oral Jelly pas cher – kamagra oral jelly
pharmacie en ligne pas cher: pharmacie en ligne sans ordonnance – Achat mГ©dicament en ligne fiable pharmafst.com
acheter mГ©dicament en ligne sans ordonnance pharmacie en ligne pas cher pharmacie en ligne france livraison belgique pharmafst.shop
https://pharmafst.com/# pharmacie en ligne france pas cher
kamagra gel: Kamagra Commander maintenant – Kamagra Commander maintenant
kamagra 100mg prix: kamagra oral jelly – kamagra en ligne
Kamagra Oral Jelly pas cher: Acheter Kamagra site fiable – kamagra 100mg prix
https://kamagraprix.com/# kamagra pas cher
pharmacie en ligne france fiable pharmacie en ligne acheter mГ©dicament en ligne sans ordonnance pharmafst.shop
Tadalafil achat en ligne: cialis sans ordonnance – Cialis sans ordonnance 24h tadalmed.shop
pharmacie en ligne france livraison internationale: Pharmacie en ligne France – pharmacie en ligne france livraison internationale pharmafst.com
http://pharmafst.com/# pharmacies en ligne certifiГ©es
olympe: olympe casino cresus – olympe casino avis
olympe: casino olympe – casino olympe
olympe olympe casino cresus
olympe casino: olympe casino avis – olympe casino avis
casino olympe olympe casino avis
casino olympe: olympe casino avis – olympe casino avis
olympe: olympe casino en ligne – olympe casino cresus
casino olympe olympe casino avis
olympe casino cresus: olympe – olympe casino avis
olympe casino cresus: olympe casino cresus – olympe casino avis
olympe casino avis casino olympe
olympe casino: olympe casino en ligne – olympe casino avis
olympe casino en ligne olympe casino
olympe: olympe casino en ligne – olympe casino avis
casino olympe: olympe casino cresus – olympe casino cresus
olympe casino en ligne: olympe casino avis – olympe casino
olympe casino cresus: casino olympe – casino olympe
olympe casino olympe
olympe casino: olympe casino avis – olympe casino
https://olympecasino.pro/# olympe casino avis
olympe: olympe casino – olympe casino avis
olympe casino cresus olympe casino cresus
casino olympe: casino olympe – olympe
olympe casino cresus: olympe casino en ligne – casino olympe
olympe casino en ligne olympe
olympe casino cresus: olympe casino en ligne – olympe casino
casino olympe: olympe – olympe casino cresus
olympe casino avis olympe
olympe casino: olympe casino avis – olympe casino cresus
olympe olympe casino cresus
olympe casino avis: olympe casino avis – olympe casino
olympe: olympe casino en ligne – olympe casino en ligne
olympe olympe
olympe casino avis: olympe casino en ligne – olympe casino cresus
olympe casino avis: olympe casino cresus – olympe casino avis
casino olympe casino olympe
olympe casino: olympe casino cresus – olympe
casino olympe: olympe casino – olympe casino en ligne
casino olympe olympe casino avis
olympe casino en ligne: olympe – olympe casino avis
olympe casino en ligne olympe casino
https://olympecasino.pro/# olympe casino en ligne
olympe: casino olympe – olympe casino
casino olympe olympe casino
olympe casino: olympe casino – olympe casino avis
olympe casino: olympe casino en ligne – olympe casino
olympe casino en ligne olympe casino cresus
casino olympe: olympe casino en ligne – olympe casino cresus
olympe casino cresus olympe casino en ligne
olympe casino en ligne: olympe casino cresus – olympe casino cresus
olympe casino avis: olympe casino avis – olympe
olympe casino olympe
olympe: olympe – olympe casino
olympe casino avis: casino olympe – olympe
olympe casino avis: olympe – olympe casino avis
olympe casino en ligne olympe casino
olympe: olympe – olympe casino en ligne
olympe casino cresus: olympe casino cresus – olympe casino avis
olympe olympe casino avis
olympe casino: olympe casino – olympe
olympe: casino olympe – olympe casino avis
olympe casino: olympe casino – casino olympe
olympe casino en ligne olympe casino avis
olympe casino avis: olympe casino en ligne – olympe casino cresus
olympe: olympe casino avis – olympe casino en ligne
olympe olympe casino en ligne
olympe casino: olympe casino avis – olympe casino
olympe casino en ligne: olympe casino en ligne – casino olympe
https://olympecasino.pro/# olympe casino cresus
olympe casino en ligne: olympe casino en ligne – olympe casino cresus
olympe casino avis olympe casino avis
olympe casino cresus: casino olympe – olympe casino
olympe casino cresus: olympe casino en ligne – olympe casino cresus
olympe casino avis olympe casino en ligne
olympe casino avis: olympe casino avis – olympe casino
olympe casino en ligne: casino olympe – olympe casino en ligne
https://olympecasino.pro/# olympe
olympe casino cresus olympe casino
casino olympe: olympe – olympe
olympe casino cresus: olympe casino en ligne – olympe
olympe casino cresus: casino olympe – olympe
https://olympecasino.pro/# olympe casino en ligne
usa canada pharm: usa canada pharm – canada rx pharmacy
https://usacanadapharm.shop/# usa canada pharm
usa canada pharm: usa canada pharm – canadian world pharmacy
USACanadaPharm canadian pharmacy antibiotics usa canada pharm
canadian pharmacy in canada: canadapharmacyonline – usa canada pharm
http://usacanadapharm.com/# legitimate canadian online pharmacies
usa canada pharm: USACanadaPharm – USACanadaPharm
usa canada pharm: safe canadian pharmacy – USACanadaPharm
https://usacanadapharm.shop/# canadian pharmacies comparison
best canadian pharmacy online: USACanadaPharm – USACanadaPharm
online canadian drugstore usa canada pharm online canadian pharmacy reviews
recommended canadian pharmacies https://usacanadapharm.shop/# usa canada pharm
best canadian online pharmacy reviews
canadian pharmacy drugs online: canadian pharmacy no scripts – canadianpharmacyworld com
https://usacanadapharm.com/# canadian pharmacy meds review
onlinecanadianpharmacy: usa canada pharm – canada drugs
canada pharmacy 24h: USACanadaPharm – onlinecanadianpharmacy
cross border pharmacy canada usa canada pharm best canadian pharmacy to buy from
https://usacanadapharm.com/# USACanadaPharm
canadian world pharmacy: trustworthy canadian pharmacy – canadian pharmacy in canada
USACanadaPharm: usa canada pharm – usa canada pharm
https://usacanadapharm.com/# online canadian pharmacy
usa canada pharm: legit canadian pharmacy online – USACanadaPharm
usa canada pharm: usa canada pharm – reliable canadian pharmacy
usa canada pharm USACanadaPharm usa canada pharm
https://usacanadapharm.shop/# USACanadaPharm
usa canada pharm: usa canada pharm – canadian pharmacy world
canadian pharmacy mall: canadian pharmacy cheap – best online canadian pharmacy
canadian pharmacy 365: USACanadaPharm – canadian discount pharmacy
https://usacanadapharm.shop/# usa canada pharm
canadian pharmacy canadian pharmacy world pharmacy rx world canada
usa canada pharm: canadian pharmacy sarasota – the canadian drugstore
http://usacanadapharm.com/# usa canada pharm
rate canadian pharmacies: canadapharmacyonline com – usa canada pharm
USACanadaPharm canadian pharmacy store buy canadian drugs
https://usacanadapharm.shop/# pharmacy com canada
is canadian pharmacy legit: USACanadaPharm – canadian pharmacy world
п»їlegitimate online pharmacies india Online medicine home delivery USA India Pharm
UsaIndiaPharm: india online pharmacy – world pharmacy india
USA India Pharm: USA India Pharm – india pharmacy mail order
UsaIndiaPharm: indian pharmacy – USA India Pharm
https://usaindiapharm.com/# buy medicines online in india
USA India Pharm: top online pharmacy india – UsaIndiaPharm
USA India Pharm UsaIndiaPharm cheapest online pharmacy india
https://usaindiapharm.shop/# UsaIndiaPharm
indianpharmacy com: indian pharmacy paypal – top 10 pharmacies in india
UsaIndiaPharm: USA India Pharm – india pharmacy
UsaIndiaPharm: USA India Pharm – USA India Pharm
http://usaindiapharm.com/# online pharmacy india
USA India Pharm: USA India Pharm – USA India Pharm
UsaIndiaPharm UsaIndiaPharm world pharmacy india
Online medicine order: п»їlegitimate online pharmacies india – buy medicines online in india
UsaIndiaPharm: pharmacy website india – UsaIndiaPharm
https://usaindiapharm.shop/# USA India Pharm
USA India Pharm: indian pharmacy – buy medicines online in india
reputable indian pharmacies: india pharmacy – UsaIndiaPharm
https://usaindiapharm.com/# USA India Pharm
USA India Pharm: USA India Pharm – UsaIndiaPharm
USA India Pharm USA India Pharm UsaIndiaPharm
india online pharmacy: indian pharmacies safe – india pharmacy mail order
world pharmacy india: mail order pharmacy india – online pharmacy india
https://usaindiapharm.com/# indian pharmacy online
UsaIndiaPharm: indian pharmacies safe – UsaIndiaPharm
USA India Pharm UsaIndiaPharm online shopping pharmacy india
https://usaindiapharm.com/# indian pharmacy
reputable indian pharmacies: UsaIndiaPharm – top 10 pharmacies in india
top 10 online pharmacy in india: mail order pharmacy india – USA India Pharm
USA India Pharm: reputable indian pharmacies – USA India Pharm
http://usaindiapharm.com/# mail order pharmacy india
cheapest online pharmacy india: USA India Pharm – USA India Pharm
best online pharmacy india: india online pharmacy – indian pharmacy
UsaIndiaPharm: reputable indian online pharmacy – USA India Pharm
Online medicine home delivery UsaIndiaPharm world pharmacy india
http://usaindiapharm.com/# indian pharmacy paypal
USA India Pharm: best online pharmacy india – USA India Pharm
USA India Pharm: Online medicine order – indianpharmacy com
USA India Pharm: Online medicine order – buy prescription drugs from india
https://usaindiapharm.com/# reputable indian online pharmacy
UsaIndiaPharm indianpharmacy com top online pharmacy india
USA India Pharm: UsaIndiaPharm – UsaIndiaPharm
USA India Pharm: indian pharmacy – indianpharmacy com
UsaIndiaPharm: indian pharmacy online – USA India Pharm
Mexican pharmacy ship to USA: mexican mail order pharmacies – mexican pharmacy
mexican pharmacy: mexican pharmaceuticals online – UsMex Pharm
USMexPharm UsMex Pharm UsMex Pharm
http://usmexpharm.com/# mexican pharmacy
UsMex Pharm: certified Mexican pharmacy – mexican pharmacy
Us Mex Pharm: purple pharmacy mexico price list – mexico drug stores pharmacies
usa mexico pharmacy: mexican online pharmacies prescription drugs – usa mexico pharmacy
http://usmexpharm.com/# Mexican pharmacy ship to USA
mexican pharmacy: certified Mexican pharmacy – certified Mexican pharmacy
USMexPharm usa mexico pharmacy Us Mex Pharm
mexican pharmacy: certified Mexican pharmacy – UsMex Pharm
https://usmexpharm.shop/# mexican rx online
mexican pharmacy: usa mexico pharmacy – UsMex Pharm
mexican pharmacy: UsMex Pharm – certified Mexican pharmacy
mexican mail order pharmacies: certified Mexican pharmacy – Mexican pharmacy ship to USA
Us Mex Pharm certified Mexican pharmacy Mexican pharmacy ship to USA
UsMex Pharm: USMexPharm – п»їbest mexican online pharmacies
usa mexico pharmacy: usa mexico pharmacy – USMexPharm
https://usmexpharm.com/# Mexican pharmacy ship to USA
UsMex Pharm: usa mexico pharmacy – mexican border pharmacies shipping to usa
USMexPharm: mexican mail order pharmacies – mexican pharmacy
Mexican pharmacy ship to USA certified Mexican pharmacy mexico drug stores pharmacies
UsMex Pharm: Us Mex Pharm – best online pharmacies in mexico
Us Mex Pharm: USMexPharm – usa mexico pharmacy
Mexican pharmacy ship to USA Us Mex Pharm usa mexico pharmacy
USMexPharm: mexican pharmacy – usa mexico pharmacy
Us Mex Pharm: mexican pharmacy – USMexPharm
slot casino siteleri: deneme bonusu veren siteler – casino siteleri 2025 casinositeleri1st.com
sweet bonanza slot: sweet bonanza slot – sweet bonanza sweetbonanza1st.shop
lisansl? casino siteleri: casino siteleri 2025 – guvenilir casino siteleri casinositeleri1st.com
sweet bonanza demo sweet bonanza slot sweet bonanza siteleri sweetbonanza1st.com
slot casino siteleri: lisansl? casino siteleri – casino siteleri 2025 casinositeleri1st.com
online casino bet: casibom – bonus veren bahis siteleri yasal casibom1st.com
canlД± casino bonusu veren siteler: casibom – en iyi casino sitesi casibom1st.com
sweet bonanza yorumlar: sweet bonanza giris – sweet bonanza sweetbonanza1st.shop
sweet bonanza 1st: sweet bonanza yorumlar – sweet bonanza demo sweetbonanza1st.shop
https://sweetbonanza1st.shop/# sweet bonanza demo
pronet giriş casibom guncel giris gerçek paralı casino oyunları casibom1st.shop
sweet bonanza yorumlar: sweet bonanza giris – sweet bonanza giris sweetbonanza1st.shop
casino en iyi siteler: casibom guncel adres – online casino websites casibom1st.com
sweet bonanza demo: sweet bonanza oyna – sweet bonanza slot sweetbonanza1st.shop
slot casino siteleri: casino siteleri 2025 – guvenilir casino siteleri casinositeleri1st.com
spor siteleri listesi: casibom mobil giris – casino gГјncel giriЕџ casibom1st.com
bilinmeyen bahis siteleri: casibom – deneme bonusu veren bГјtГјn siteler casibom1st.com
casino siteleri lisansl? casino siteleri casino siteleri 2025 casinositeleri1st.shop
bonus veren yasal bahis siteleri: casibom guncel giris – superbetin giriЕџ casibom1st.com
sweet bonanza giris: sweet bonanza siteleri – sweet bonanza siteleri sweetbonanza1st.shop
mobil bahis siteleri: casibom resmi – deneme bonusu site casibom1st.com
deneme bonusu bahis siteleri: casibom 1st – canlД± +18 casibom1st.com
deneme bonusu veren siteler: casino siteleri – bonus veren yasal siteler casinositeleri1st.com
sweet bonanza siteleri: sweet bonanza siteleri – sweet bonanza 1st sweetbonanza1st.shop
slot casino siteleri: guvenilir casino siteleri – deneme bonusu veren siteler casinositeleri1st.com
https://casibom1st.shop/# casino maxi
sweet bonanza siteleri: sweet bonanza siteleri – sweet bonanza sweetbonanza1st.shop
lisansl? casino siteleri slot casino siteleri casino siteleri casinositeleri1st.shop
sweet bonanza: sweet bonanza 1st – sweet bonanza yorumlar sweetbonanza1st.shop
deneme bonusu veren siteler yorumlar: casibom giris adresi – deneme bonusu veren yeni siteler 2025 casibom1st.com
sweet bonanza slot: sweet bonanza siteleri – sweet bonanza sweetbonanza1st.shop
slot casino siteleri: casino siteleri – casino siteleri casinositeleri1st.com
sweet bonanza 1st: sweet bonanza oyna – sweet bonanza giris sweetbonanza1st.shop
sweet bonanza yorumlar sweet bonanza siteleri sweet bonanza yorumlar sweetbonanza1st.com
https://sweetbonanza1st.shop/# sweet bonanza siteleri
slot casino: casibom 1st – gercek para kazandД±ran casino oyunlarД± casibom1st.com
casino siteleri: deneme bonusu veren siteler – casino siteleri 2025 casinositeleri1st.com
zithromax generic price: ZithPharmOnline – purchase zithromax online
https://zithpharmonline.com/# where to get zithromax
ZithPharmOnline: zithromax online australia – zithromax without prescription
drug lisinopril 5 mg: lisinopril 10 mg price in india – Lisin Express
prednisone 5mg price: Pred Pharm Net – 50mg prednisone tablet
https://clomfastpharm.com/# where to buy generic clomid without insurance
Clom Fast Pharm: cost of clomid no prescription – Clom Fast Pharm
zithromax tablets for sale: where can i get zithromax over the counter – buy zithromax online australia
AmOnlinePharm: AmOnlinePharm – prescription for amoxicillin
AmOnlinePharm amoxicillin 500 mg AmOnlinePharm
https://lisinexpress.shop/# lisinopril tab 5 mg price
average price of prednisone: where can you buy prednisone – prednisone cream brand name
prednisone 10 mg online: Pred Pharm Net – Pred Pharm Net
AmOnlinePharm: can you buy amoxicillin over the counter canada – AmOnlinePharm
Pred Pharm Net: Pred Pharm Net – Pred Pharm Net
http://predpharmnet.com/# prednisone buying
order clomid tablets: get clomid now – where can i get clomid
Pred Pharm Net: Pred Pharm Net – prednisone 10mg prices
Clom Fast Pharm: Clom Fast Pharm – Clom Fast Pharm
buy amoxicillin 500mg canada amoxicillin 250 mg price in india canadian pharmacy amoxicillin
https://zithpharmonline.com/# ZithPharmOnline
AmOnlinePharm: AmOnlinePharm – amoxicillin 500 mg without prescription
AmOnlinePharm: AmOnlinePharm – amoxicillin 1000 mg capsule
prednisone uk buy: Pred Pharm Net – Pred Pharm Net
where can i get cheap clomid without dr prescription: Clom Fast Pharm – can i get clomid without rx
http://clomfastpharm.com/# where to buy cheap clomid
Lisin Express: Lisin Express – purchase lisinopril
Lisin Express Lisin Express where to buy lisinopril without prescription
ZithPharmOnline: ZithPharmOnline – ZithPharmOnline
Lisin Express: Lisin Express – Lisin Express
can i buy zithromax over the counter: ZithPharmOnline – zithromax price south africa
https://lisinexpress.shop/# zestril coupon
Lisin Express: lisinopril 15 mg tablets – lipinpril
ZithPharmOnline: buy zithromax online cheap – where can i get zithromax
ZithPharmOnline buy zithromax online with mastercard ZithPharmOnline
Pred Pharm Net: Pred Pharm Net – 30mg prednisone
http://amonlinepharm.com/# AmOnlinePharm
buying clomid tablets: order generic clomid pills – can you get clomid online
Lisin Express: can you order lisinopril online – Lisin Express
https://clomfastpharm.com/# buying clomid tablets
Clom Fast Pharm: Clom Fast Pharm – Clom Fast Pharm
order prednisone with mastercard debit prednisone over the counter cost prednisone 20 mg tablets
Pred Pharm Net: prednisone 475 – Pred Pharm Net
http://zithpharmonline.com/# ZithPharmOnline
Pred Pharm Net: purchase prednisone no prescription – prednisone 0.5 mg
Clom Fast Pharm: Clom Fast Pharm – Clom Fast Pharm
mexican mail order pharmacies п»їbest mexican online pharmacies Agb Mexico Pharm
https://wwwindiapharm.shop/# online shopping pharmacy india
www india pharm: reputable indian pharmacies – online shopping pharmacy india
mexican rx online: Agb Mexico Pharm – Agb Mexico Pharm
best online pharmacy india: Online medicine order – indian pharmacy paypal
https://agbmexicopharm.com/# reputable mexican pharmacies online
canadian pharmacy king reviews go canada pharm canadian pharmacy no rx needed
canadian drugs online: GoCanadaPharm – canada pharmacy world
canadian pharmacy world reviews: GoCanadaPharm – canadian drug prices
https://agbmexicopharm.shop/# Agb Mexico Pharm
www india pharm: www india pharm – buy medicines online in india
Agb Mexico Pharm: Agb Mexico Pharm – purple pharmacy mexico price list
https://gocanadapharm.shop/# canadian pharmacy reviews
canadian online pharmacy go canada pharm best online canadian pharmacy
www india pharm: top online pharmacy india – www india pharm
ed meds online canada: GoCanadaPharm – canadian pharmacy price checker
canadian pharmacy online reviews: go canada pharm – canadian discount pharmacy
https://wwwindiapharm.com/# www india pharm
Agb Mexico Pharm: Agb Mexico Pharm – Agb Mexico Pharm
online pharmacy canada canadian pharmacy 365 canadian pharmacy world
Agb Mexico Pharm: Agb Mexico Pharm – best online pharmacies in mexico
https://gocanadapharm.shop/# canadian online pharmacy reviews
precription drugs from canada: canadian pharmacy 24 – canadian family pharmacy
canadian pharmacy 24h com safe: GoCanadaPharm – canada drugs online
https://agbmexicopharm.shop/# Agb Mexico Pharm
п»їbest mexican online pharmacies Agb Mexico Pharm Agb Mexico Pharm
Agb Mexico Pharm: buying prescription drugs in mexico – mexican border pharmacies shipping to usa
п»їbest mexican online pharmacies: Agb Mexico Pharm – п»їbest mexican online pharmacies
indian pharmacy online: www india pharm – www india pharm
canadian pharmacy meds: GoCanadaPharm – reputable canadian online pharmacy
www india pharm Online medicine home delivery reputable indian online pharmacy
canadian pharmacy ltd: GoCanadaPharm – canadian pharmacy drugs online
https://agbmexicopharm.com/# buying prescription drugs in mexico
rate canadian pharmacies: canadian pharmacy – best rated canadian pharmacy
Agb Mexico Pharm: buying prescription drugs in mexico – Agb Mexico Pharm
Kamagra kaufen ohne Rezept Kamagra kaufen ohne Rezept Kamagra Oral Jelly kaufen
apotek online recept: Apotek hemleverans recept – apotek online recept
https://apotekonlinerecept.shop/# apotek pa nett
Apotek hemleverans recept: apotek online – apotek pa nett
https://apotekonlinerecept.com/# Apotek hemleverans recept
http://kamagrapotenzmittel.com/# Kamagra Gel
online apotheek: Apotheek Max – Apotheek online bestellen
Kamagra Oral Jelly kamagra Kamagra kaufen ohne Rezept
Apoteket online: apotek online recept – Apoteket online
https://kamagrapotenzmittel.com/# Kamagra online bestellen
http://apotheekmax.com/# Online apotheek Nederland met recept
Kamagra Oral Jelly kaufen: Kamagra online bestellen – Kamagra Gel
apotek online recept: Apotek hemleverans idag – Apotek hemleverans recept
https://apotekonlinerecept.com/# Apotek hemleverans recept
Kamagra Original: Kamagra online bestellen – Kamagra kaufen ohne Rezept
Apotheek online bestellen Apotheek online bestellen Online apotheek Nederland zonder recept
https://apotekonlinerecept.com/# Apotek hemleverans recept
online apotheek: Betrouwbare online apotheek zonder recept – Beste online drogist
https://apotekonlinerecept.com/# Apotek hemleverans idag
apotek online recept: Apotek hemleverans idag – Apotek hemleverans idag
http://kamagrapotenzmittel.com/# Kamagra online bestellen
Beste online drogist Beste online drogist Betrouwbare online apotheek zonder recept
Kamagra kaufen: Kamagra Gel – Kamagra online bestellen
Kamagra Gel: Kamagra Gel – Kamagra online bestellen
http://apotekonlinerecept.com/# Apotek hemleverans idag
apotek pa nett: Apoteket online – apotek online
apotek pa nett: apotek online recept – apotek online recept
https://kamagrapotenzmittel.com/# Kamagra online bestellen
Betrouwbare online apotheek zonder recept de online drogist kortingscode Beste online drogist
apotek pa nett: apotek online – Apoteket online
http://kamagrapotenzmittel.com/# Kamagra Gel
Apoteket online: apotek pa nett – apotek online
https://kamagrapotenzmittel.com/# Kamagra Oral Jelly kaufen
kamagra: Kamagra kaufen ohne Rezept – kamagra
ApotheekMax: Apotheek Max – online apotheek
Apotek hemleverans recept Apoteket online apotek online
https://kamagrapotenzmittel.com/# Kamagra Oral Jelly
de online drogist kortingscode: Online apotheek Nederland met recept – ApotheekMax
https://kamagrapotenzmittel.shop/# kamagra
Kamagra kaufen Kamagra Oral Jelly kaufen Kamagra kaufen
kamagra: Kamagra kaufen – kamagra
Kamagra kaufen ohne Rezept: Kamagra Gel – Kamagra Gel
https://apotekonlinerecept.com/# Apotek hemleverans recept
Buy Tadalafil 20mg Cheap Cialis Buy Tadalafil 20mg
пинап казино – pinup 2025
пин ап казино официальный сайт: https://pinupkz.life/
пин ап зеркало – пин ап казино зеркало
пин ап казино – пин ап казино
пин ап казино официальный сайт: https://pinupkz.life/
buy generic 100mg viagra online buy generic 100mg viagra online Generic100mgEasy
пин ап – пинап казино
пинап казино – пинап казино
пин ап вход: https://pinupkz.life/
пин ап зеркало – пинап казино
пин ап казино зеркало – pinup 2025
пин ап казино официальный сайт: https://pinupkz.life/
kamagra 100mg kopen kamagra pillen kopen kamagra jelly kopen
пин ап – пин ап вход
пин ап казино зеркало – пин ап казино зеркало
пин ап казино зеркало: https://pinupkz.life/
пин ап казино зеркало – пин ап вход
пин ап казино зеркало – пин ап казино официальный сайт
pinup 2025: https://pinupkz.life/
Kamagra kamagra 100mg kopen kamagra kopen nederland
пин ап вход – пин ап казино официальный сайт
пин ап казино зеркало – пин ап вход
пин ап казино зеркало: https://pinupkz.life/
пин ап казино – пин ап казино зеркало
пин ап зеркало – пин ап казино зеркало
пин ап казино зеркало: https://pinupkz.life/
https://kamagrakopen.pro/# Kamagra Kopen Online
buy generic 100mg viagra online buy generic 100mg viagra online Generic 100mg Easy
cialis without a doctor prescription: cialis without a doctor prescription – Tadalafil Easy Buy
kamagra jelly kopen: KamagraKopen.pro – kamagra 100mg kopen
https://generic100mgeasy.shop/# Generic100mgEasy
https://generic100mgeasy.shop/# Cheapest Sildenafil online
Generic 100mg Easy: Generic100mgEasy – buy generic 100mg viagra online
https://generic100mgeasy.com/# buy generic 100mg viagra online
https://generic100mgeasy.com/# over the counter sildenafil
Generic100mgEasy Generic100mgEasy Generic100mgEasy
Generic100mgEasy: Generic 100mg Easy – Generic100mgEasy
https://tadalafileasybuy.shop/# Generic Cialis without a doctor prescription
cialis without a doctor prescription: TadalafilEasyBuy.com – Tadalafil Easy Buy
https://tadalafileasybuy.com/# TadalafilEasyBuy.com
kamagra gel kopen: kamagra gel kopen – Kamagra
Tadalafil Easy Buy Buy Tadalafil 10mg TadalafilEasyBuy.com
https://generic100mgeasy.shop/# buy generic 100mg viagra online
https://kamagrakopen.pro/# kamagra 100mg kopen
Tadalafil Easy Buy: Tadalafil Easy Buy – Tadalafil Easy Buy
buy generic 100mg viagra online: Viagra generic over the counter – Generic100mgEasy
Kamagra Kopen Online: kamagra jelly kopen – Officiele Kamagra van Nederland
https://tadalafileasybuy.shop/# Tadalafil Easy Buy
https://tadalafileasybuy.shop/# Tadalafil Easy Buy
Generic100mgEasy: Cheap generic Viagra online – Generic100mgEasy
buy generic 100mg viagra online buy generic 100mg viagra online Generic100mgEasy
Kamagra: kamagra kopen nederland – Officiele Kamagra van Nederland
https://kamagrakopen.pro/# Kamagra
https://tadalafileasybuy.com/# п»їcialis generic
Generic100mgEasy: Generic100mgEasy – Viagra tablet online
cialis for sale: TadalafilEasyBuy.com – TadalafilEasyBuy.com
https://generic100mgeasy.shop/# Generic 100mg Easy
http://tadalafileasybuy.com/# TadalafilEasyBuy.com
Generic100mgEasy buy Viagra online cheapest viagra
Buy Tadalafil 20mg: TadalafilEasyBuy.com – TadalafilEasyBuy.com
https://kamagrakopen.pro/# Kamagra
Officiele Kamagra van Nederland: Kamagra Kopen Online – kamagra pillen kopen
kamagra gel kopen: Kamagra – KamagraKopen.pro
Kamagra Kopen kamagra 100mg kopen kamagra gel kopen
https://generic100mgeasy.shop/# Generic100mgEasy
https://generic100mgeasy.com/# Generic 100mg Easy
Generic100mgEasy: cheap viagra – Generic 100mg Easy
kamagra 100mg kopen: Officiele Kamagra van Nederland – Kamagra Kopen Online
https://generic100mgeasy.com/# Generic 100mg Easy
https://kamagrakopen.pro/# kamagra kopen nederland
Buy Tadalafil 5mg: Tadalafil Tablet – cialis without a doctor prescription
Tadalafil Easy Buy TadalafilEasyBuy.com cialis without a doctor prescription
legitimate canadian pharmacies: Certified International Pharmacy Online – best canadian online pharmacy reviews
http://mexicanpharminter.com/# Mexican Pharm International
northwest pharmacy canada
best canadian pharmacy to buy from: canadian drugstore online no prescription – canada drug pharmacy
http://interpharmonline.com/# my canadian pharmacy reviews
Mexican Pharm International MexicanPharmInter mexican pharmacy online store
canadian pharmacy cheap: InterPharmOnline.com – safe reliable canadian pharmacy
https://mexicanpharminter.shop/# mexican pharmacy online
recommended canadian pharmacies
http://mexicanpharminter.com/# mexican pharmacy online store
reliable mexican pharmacies: mexican pharmacy online order – Mexican Pharm International
http://interpharmonline.com/# canadian pharmacy meds reviews
buying from online mexican pharmacy: Mexican Pharm Inter – reliable mexican pharmacies
https://mexicanpharminter.com/# MexicanPharmInter
canadian pharmacy ltd
reliable mexican pharmacies: buying from online mexican pharmacy – mexican pharmacy online store
http://indiamedfast.com/# india pharmacy without prescription
canada drugs online review
Mexican Pharm Inter: MexicanPharmInter – mexican drug stores online
http://interpharmonline.com/# reddit canadian pharmacy
canadian drug
lowest prescription prices online india: buying prescription drugs from india – IndiaMedFast.com
http://indiamedfast.com/# IndiaMedFast.com
reputable canadian pharmacy
mexican drug stores online: Mexican Pharm International – mexican pharmacy online order
789alo: dang nh?p alo789 – alo 789
Thanks for sharing. I read many of your blog posts, cool, your blog is very good.